Hitos clave en el desarrollo de la vacuna mRNA-1273 contra el nuevo coronavirus.
- 11 de enero. Las autoridades chinas compartieron la secuencia genética del nuevo coronavirus.
- 13 de enero. El equipo de investigación de enfermedades infecciosas de NIH y Moderna finalizó la secuencia para mRNA-1273. Moderna movilizada hacia la fabricación clínica. El NIAID, parte de los NIH, reveló su intención de llevar a cabo un estudio de fase 1 utilizando ARNm-1273 en respuesta a la amenaza del coronavirus. La fabricación de este lote fue financiada por la Coalition for Epidemic Preparedness Innovations (CEPI).
- 7 de febrero. Se completó el primer lote clínico de ARNm-1273, un total de 25 días desde la selección de la secuencia hasta la fabricación de la vacuna. El lote luego pasó a las pruebas analíticas para su liberación.
- 24 de febrero. Moderna envió el primer lote clínico de ARNm-1273 al NIH para su uso en su estudio clínico de fase 1.
- 4 de marzo. La FDA completó su revisión de la solicitud de IND presentada por el NIH para mRNA-1273 y permitió que el estudio procediera a ensayos clínicos.
- 16 de marzo. El NIH anunció que se dosificó al primer participante en su estudio de fase 1 del ARNm-1273, un total de 63 días desde la selección de la secuencia hasta la primera dosificación en humanos.
- 23 de marzo. Si bien es probable que una vacuna disponible comercialmente no esté disponible durante al menos 12-18 meses, Moderna informó que es posible que, en caso de uso de emergencia, una vacuna esté disponible para algunas personas, posiblemente incluyendo profesionales de la salud, en el otoño de 2020. Moderna confirmó que está aumentando la capacidad de fabricación hacia la producción de millones de dosis por mes, en la forma potencial de viales individuales o multidosis.2
- 27 de marzo. El NIH anunció que la Universidad de Emory en Atlanta comenzaría a inscribir voluntarios adultos sanos de entre 18 y 55 años en el estudio de fase 1 dirigido por los NIH del ARNm-1273.
- 16 de abril. BARDA otorgó a Moderna hasta $ 483 millones para acelerar el desarrollo del ARNm-1273 para permitir la producción a gran escala en 2020 para una respuesta pandémica. El estudio de fase 1 dirigido por los NIH del ARNm-1273 completó la inscripción de tres cohortes de dosis (25 µg, 100 µg y 250 µg) y se amplió a seis cohortes adicionales: tres cohortes de adultos mayores (edades 56-70) y tres cohortes de adultos mayores (71 años o más).
- 27 de abril. Moderna presentó un IND a la FDA de EE. UU. Para el estudio de fase 2 del ARNm-1273.
- El 1 de mayo. Moderna y Lonza anunciaron una colaboración estratégica mundial con el objetivo de permitir la fabricación de hasta mil millones de dosis de ARNm-1273 por año.
- El 6 de mayo, Moderna informó que Anthony S. Fauci, M.D., Director de NIAID, participó en una entrevista con National Geographic, que describió su evaluación de los resultados de ciertas pruebas preclínicas relacionadas con el estudio clínico de fase 1 en curso de ARNm-1273.
- 12 de mayo. Moderna recibió la designación Fast Track de la FDA para mRNA-1273.
- 18 de mayo. Moderna anunció datos positivos positivos de la Fase 1 para ARNm-1273.
INTRODUCCIÓN
SARS-CoV-2 es un virus de ARN perteneciente a la familia de coronavirus, que recibe este nombre por la apariencia característica de las proteínas de su cubierta.
Presentación esquemática de la organización del genoma del SARS-CoV-2, los ARNm subgenómicos canónicos y la estructura del virión.
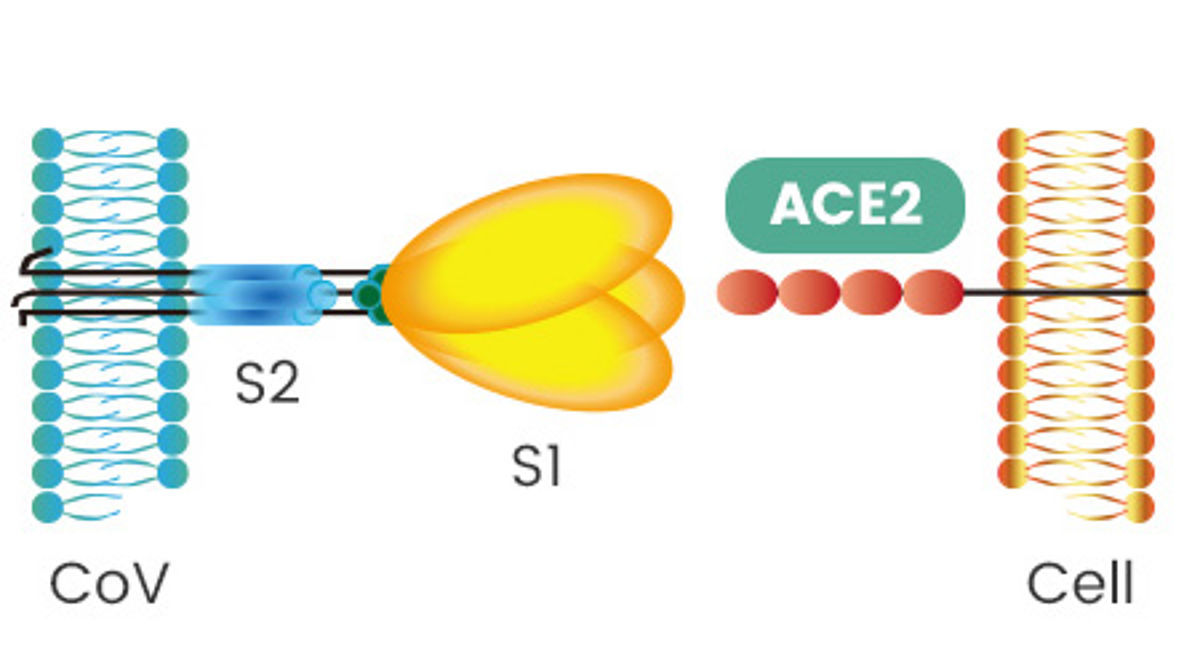
TMPRSS2 activa las proteínas S de SARS-CoV2 y se expresa en las células del epitelio respiratorio humano que también expresan el receptor de SARS-CoV, ACE2
VACUNAS BASADAS EN EL ARN MENSAJERO
Existen cuatro ventajas principales de seguridad y eficacia del uso de vacunas antivirales basadas en ARNm sobre los enfoques tradicionales.
- Primero, las vacunas antivirales basadas en ARNm minimizan el riesgo potencial de infección y mutagénesis inducida por inserción debido a la degradación natural del ARNm en el microambiente celular.
- En segundo lugar, la alta eficacia del inmunógeno debido a modificaciones estructurales de ARNm modificadas mejora su estabilidad y eficacia de traducción.
- En tercer lugar, la alta potencia de las vacunas basadas en ARNm capaces de generar inmunoglobulinas neutralizadoras antivirales potentes con solo una o dos inmunizaciones de dosis bajas puede inducir respuestas inmunes fuertes activando las células T CD8 + y CD4 + .
- Cuarto, la ingeniería de producción de ARNm facilita la producción a gran escala de suficientes dosis de vacunas requeridas para tratar poblaciones en masa. Todos estos factores hacen que la vacuna de ARNm sea más adecuada para una respuesta rápida a la pandemia emergente de COVID-19.
Las vacunas de ARN funcionan mediante la introducción de una secuencia de ARNm en las células del huésped. Este ARNm codifica un antígeno específico de la enfermedad. Una vez dentro de una célula, el ARNm ordena a la célula que produzca el antígeno, que es reconocido por el sistema inmunitario que produce un anticuerpo y/o una respuesta celular.
Esto imita el proceso por el cual ocurren las infecciones virales naturales, donde la información de los genomas virales se usa para producir proteínas virales dentro de una célula. Potencialmente, esto puede mejorar la respuesta inmune, incluidas las respuestas mejoradas de células B y T
La vacuna ARNm-1273 es una cadena sintética de ARNm encapsulada en nanopartículas lipídicas que codifica la proteína de espiga (S) estabilizada por prefusión. El ARNm se estabiliza para protegerlo de las enzimas que podrían descomponerlo.
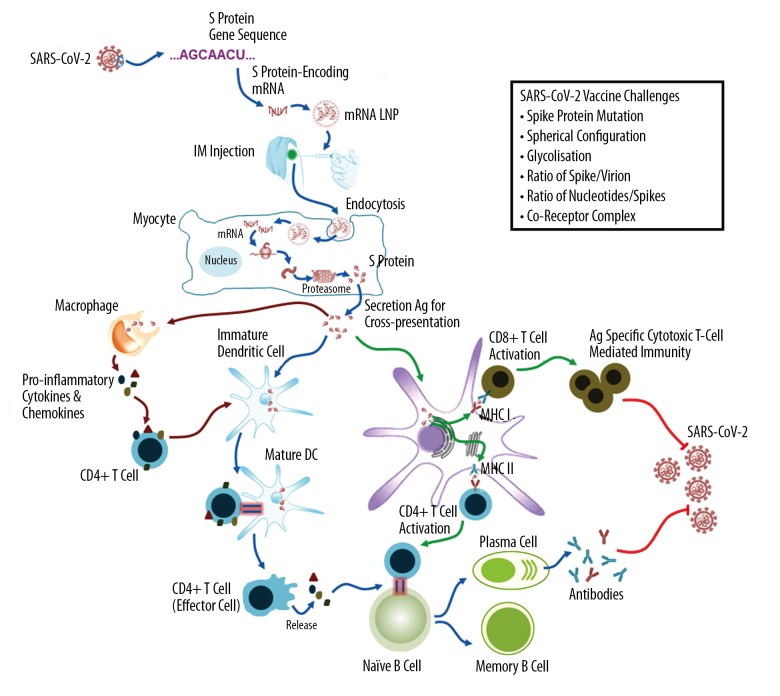
Diagrama esquemático de la vacuna ARNm-1273 cadena sintética de ARNm recombinante que codifica la proteína espiga (proteína S) del SARS-CoV-2 que ingresa a las células y se utiliza para producir proteínas antigénicas virales dentro de la célula.
Una vez inyectados en el músculo, los miocitos toman la nanopartícula lipídica (LNP) y luego liberan los ARNm en el citoplasma para su traducción en las proteínas S. Estas proteínas S sintetizadas endógenamente se secretarán para activar las respuestas inmunes humoral y celular.
Proteína S - proteína espiga; IM - intramuscular, LNP - nanopartícula lipídica; DC - célula dendrítica; MHC - complejo principal de histocompatibilidad; Ag - antígeno.
 PROF. DR. FERNANDO GALAN
PROF. DR. FERNANDO GALAN
