Descubrimiento de Cas9 y PAM
Mayo de 2005 - Alexander Bolotin, Instituto Nacional Francés de Investigación Agrícola (INRA)
Bolotin estaba estudiando la bacteria Streptococcus thermophilus, que acababa de secuenciarse, revelando un locus CRISPR inusual. Aunque la matriz CRISPR era similar a los sistemas reportados anteriormente, carecía de algunos de los genes cas conocidos y en su lugar contenía genes Cas novedosos, incluido uno que codificaba una proteína grande que predijeron que tenía actividad nucleasa, que ahora se conoce como Cas9. Además, señalaron que los espaciadores, que tienen homología con genes virales, comparten una secuencia común en un extremo. La secuencia en el virus que coincide con el espaciador adquirido se llama protoespaciador o PAM (Protospacer Adjacent Motif).Esta secuencia se requiere para el reconocimiento del objetivo.
Los espaciadores representan un historial de infecciones antiguas que ayuda a proteger al microorganismo en caso de que estas amenazas reaparezcan.
En 2008, el grupo de John van der Oost, de la Universidad de Wageningen (Holanda) descubrieron, que secuencias espaciadoras derivadas del virus se transcribían en pequeños RNA , a los cuales se denominó CRISPR RNA, crRNAs. Y guiaban a la proteína Cas hacia el DNA diana.
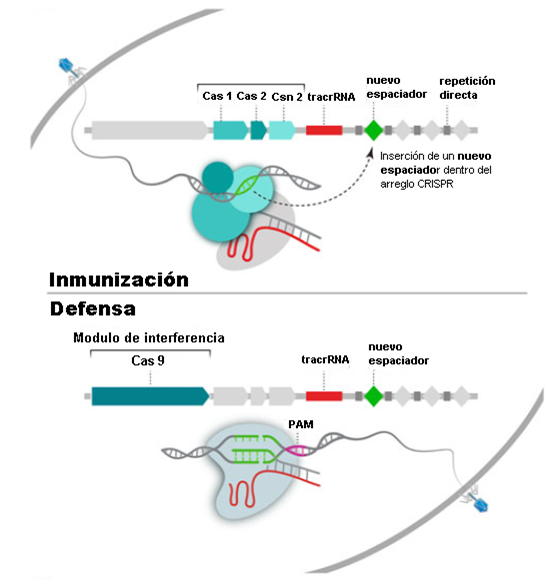
Los sistemas inmunes adaptativos CRISPR-Cas ayudan a las bacterias a defenderse de los virus y otros materiales genéticos extraños.
- Durante la fase de inmunización (arriba), un módulo de adaptación inserta un nuevo espaciador, una secuencia de ADN derivado del genoma del virus invasor, en la matriz CRISPR.
- Durante la fase de defensa (abajo), los espaciadores se convierten en ARN guía que dirigen un módulo de interferencia a secuencias diana coincidentes (PAM), que luego son cortadas.
Interferencia de ADN mediada por CRISPR-Cas9 en la inmunidad adaptativa bacteriana.
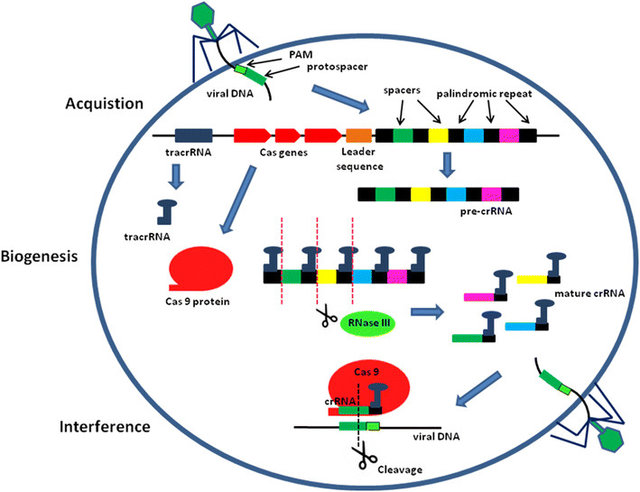
Un locus CRISPR típico en un sistema CRISPR-Cas tipo II comprende una serie de secuencias repetitivas (repeticiones, cuadrados negros) intercaladas por tramos cortos de secuencias no repetitivas (espaciadores, cuadrados de colores), así como un conjunto de genes CRISPR asociado (Cas)
Precediendo a los genes Cas está el gen transactivador CRISPR RNA (tracrRNA), que genera un RNA no codificante único con homología con las secuencias repetidas.
- Tras la infección del Virus, la maquinaria de adquisición incorpora un nuevo espaciador (verde oscuro)
- Una vez integrado, el nuevo espaciador se cotranscribe con todos los demás espaciadores en un ARN CRISPR precursor largo (pre-ARNcr)
- El tracrRNA se transcribe por separado y luego se hibrida con las repeticiones pre-RNAcr para la maduración del RNAcr mediante la escisión por RNasa III.
- Durante la interferencia, la estructura madura de ARNcr-tracrRNA se une a la endonucleasa Cas9 y además la dirige a escindir ADN extraño del virus que contiene una secuencia complementaria de ARNcr de 20 nt que precede a la secuencia PAM (verde claro).
Abreviaturas: ARNcr, ARN CRISPR; protoespaciador o PAM; tracrRNA, transactivador CRISPR RNA.
Arquitectura bilobular de la enzima Ca9
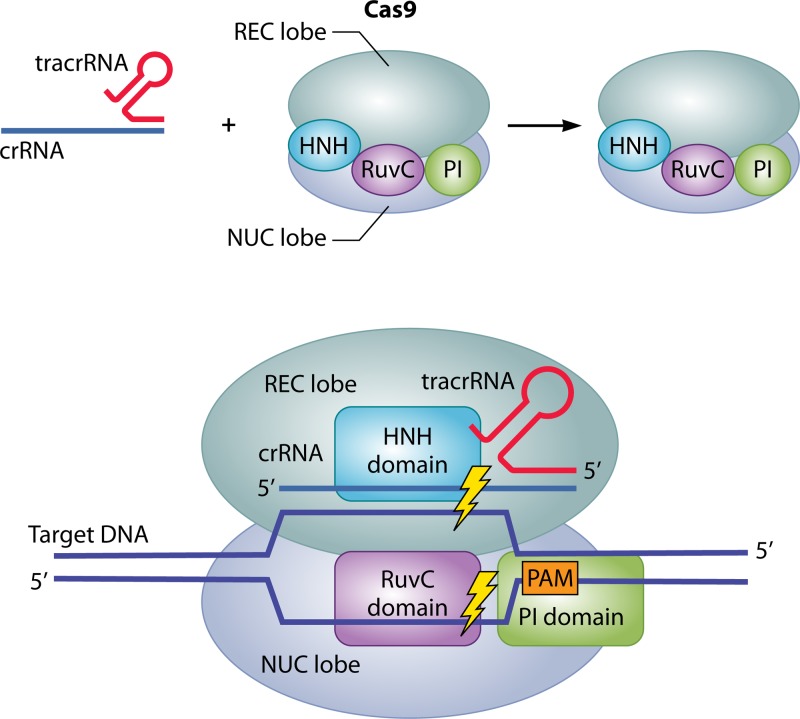
La estructura de Cas9 tiene dos lóbulos distintos,
- El lóbulo de reconocimiento de ácido nucleico alfa-helicoidal (REC)
- El lóbulo NUC contiene los dominios de nucleasa HNH y RuvC y una región C-terminal que contiene un dominio de interacción con PAM (PI).
El dominio HNH y el dominio RuvC escinden la cadena de ADN, formando un dúplex con crRNA y la otra cadena de ADN, respectivamente, de modo que se produce una ruptura de doble cadena en el ADN diana.
Mecanismo de reconocimiento y corte de la enzima Cas9
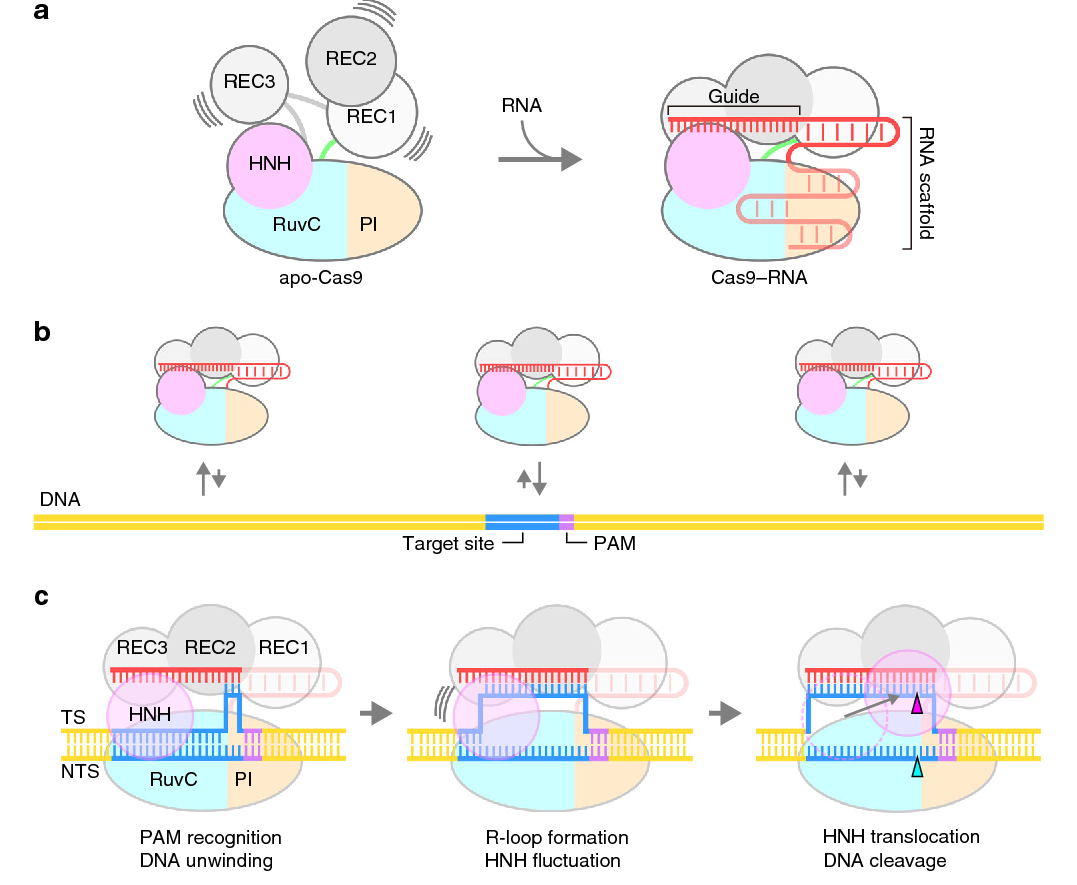 a) Ensamblaje del complejo binario Cas9-ARNcr.
a) Ensamblaje del complejo binario Cas9-ARNcr.
b) Búsqueda o interrogatorio de ADN por Cas9 – ARNcr a través de difusión tridimensional.
c) Reconocimiento y escisión del ADN por Cas9 – ARNcr.
Las divisiones de ADN por los dominios RuvC y HNH se indican mediante los triángulos cian y magenta, respectivamente. TS, cadena diana; NTS, cadena no objetivo
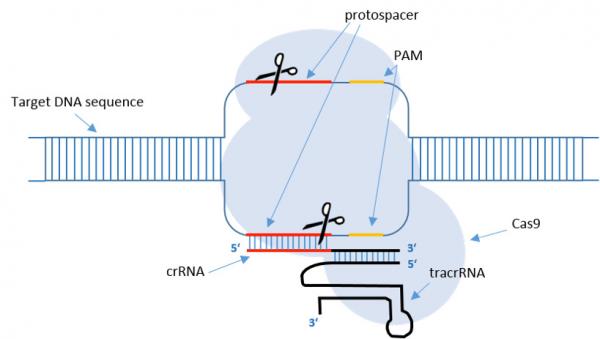
Disposición esquemática y mecanismo de escisión de ADN dirigida por crRNA por el complejo Cas9-crRNA.
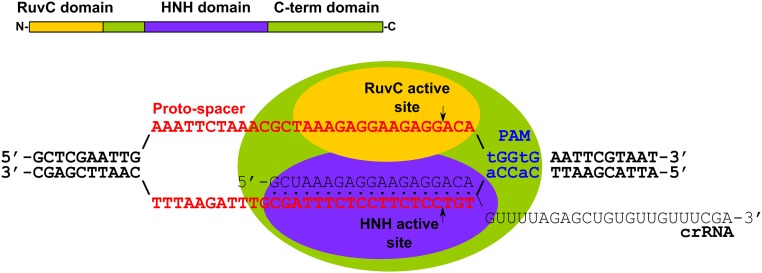
La arquitectura de dominio de Cas9 se muestra esquemáticamente en la parte superior.
El complejo Cas9-crRNA se une al doble cadena DNA que contiene un PAM.
El ARNcr se une a la cadena complementaria, lo que da como resultado la separación de la cadena de ADN y la formación del bucle R.
En el complejo, el sitio activo RuvC de Cas9 se coloca en el lugar de corte en la cadena no apareada, y el sitio activo de HNH está ubicado en el lugar de corte en la cadena de ADN unida al ARNcr.
La acción coordinada de ambos sitios activos da como resultado la ruptura de doble cadena 3 nt por delante del PAM, generando ADN de extremos romos.
Año 2010, el grupo investigador deSylvain Moineau, de la Universidad de Laval en Quebec demuestra que CRISPR-Cas9 crea roturas de doble cadena de ADN diana en posiciones precisas y también confirma que Cas9 es la única proteína necesaria para la escisión en el sistema de CRISPR-Cas9.
Año 2011 la investigadora Emmanuelle Charpentier de la Universidad de Umee realiza una pequeña secuenciación de ARN en Streptococcus pyogenes que contiene un sistema de CRISPR-Cas9 y descubre que además de la crRNA, existe un segundo ARN que llama trans-activación de CRISPR ARN (tracrRNA). Además demuestra que tracrRNA actúa conjuntamente con el crRNA para guiar a Cas9 hacia sus objetivos.
El sistema CRISPR/Cas9 tipo II de S. pyogenes
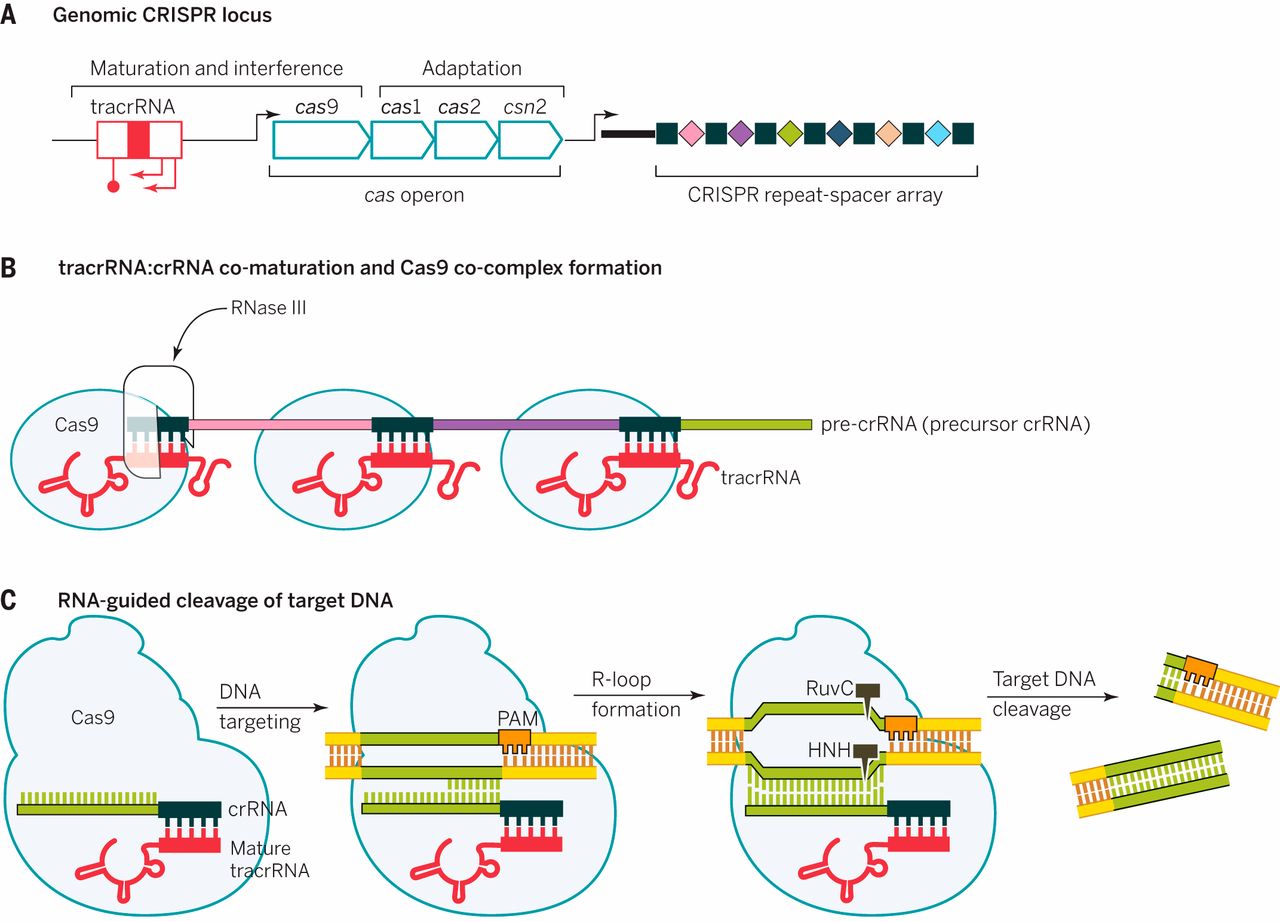
A. El operón del gen cas con tracrRNA y la matriz CRISPR.
B. Asociación de Cas9 con los dúplex de tracrRNA: crRNA, coprocesamiento de ARN por ribonucleasa III, recorte adicional.
C. El complejo Cas9 / crRNA analiza el ADN en busca de un motivo PAM (5'-NGG). El reconocimiento de un motivo de PAM induce un desenrollamiento del ADN que permite al crRNA buscar el ADN complementario adyacente al motivo PAM. Esta interacción favorece además la separación de la doble hebra de DNA más allá de la región de inicio y la formación de un bucle-R (R-loop en inglés) completo. Finalmente, el bucle-R completo provoca otro cambio conformacional en el dominio HNH, activando la actividad nucleasa de los dominios RuvC y HNH para inducir la escisión del ADN
RESUMEN APORTACIONES HISTÓRICAS
Año 2005, descubrimiento de Cas9 y PAM por Alexander Bolotin, Instituto Nacional Francés de Investigación Agrícola (INRA)
En 2008, el grupo de John van der Oost, de la Universidad de Wageningen (Holanda) descubrieron, que secuencias espaciadoras derivadas del virus se transcribían en pequeños RNA , a los cuales se denominó CRISPR RNA, crRNAs. Y guiaban a la proteína Cas hacia el DNA diana.
Año 2010, el investigador Sylvain Moineau, de la Universidad de Laval en Quebec demuestra que CRISPR-Cas9 crea roturas de doble cadena de ADN diana en posiciones precisas y también confirma que Cas9 es la única proteína necesaria para la escisión en el sistema de CRISPR-Cas9.
Año 2011, la investigadora Emmanuelle Charpentier de la Universidad de Umee descubre en el Streptococcus pyogenes - que tiene un sistema de CRISPR-Cas9 - que además del crRNA, existe un segundo ARN que llamó transactivador de CRISPR ARN (tracrRNA). Además demuestra que tracrRNA actúa conjuntamente con el crRNA para guiar a Cas9 hacia sus objetivos.
REFERENCIAS
- Bolotin A, Quinquis B, Sorokin A, Ehrlich SD. Clustered regularly interspaced short palindrome repeats (CRISPRs) have spacers of extra-chromosomal origin. Microbiology. 2005;151:2551–2561.
- Brouns SJ, Jore MM, Lundgren M, Westra ER, Slijkhuis RJ, Snijders AP, Dickman MJ, Makarova KS, Koonin EV, van der Oost J. Small CRISPR RNAs guide antiviral defense in prokaryotes. Science. 2008;321:960-4
- Garneau JE, Dupuis MÈ, Villion M, Romero DA, Barrangou R, Boyaval P, Fremaux C, Horvath P, Magadán AH, Moineau S. The CRISPR/Cas bacterial immune system cleaves bacteriophage and plasmid DNA. Nature. 2010;468:67-71
- Deltcheva E, Chylinski K, Sharma CM, Gonzales K, Chao Y, Pirzada ZA, Eckert MR, Vogel J, Charpentier E. CRISPR RNA maturation by trans-encoded small RNA and host factor RNase III. Nature. 2011; 471:602-7
Prof. Dr. Fernando Galan
