Nota previa:
Para los artículos que expondré en esta y sucesivas partes, he seguido las recomendaciones expuestas por Mavraki E, Labrum R, Sergeant K, Alston CL, Woodward C, Smith C, Knowles CVY, Patel Y, Hodsdon P, Baines JP, Blakely EL, Polke J, Taylor RW, Fratter C. en su artículo Genetic testing for mitochondrial disease: the United Kingdom best practice guidelines, en la revista Eur J Hum Genet . 2022 Dec 13. doi: 10.1038/s41431-022-01249-w.
El diagnóstico de la Enfermedad Mitocondrial es un desafío. Se sabe que >350 genes, tanto codificados por ADN nuclear como mitocondrial (ADNmt), causan enfermedades mitocondriales.
Se estima que la prevalencia de la enfermedad mitocondrial es de aproximadamente 12,5 por 100 000 en adultos y aproximadamente 4,7 por 100 000 en niños. Sin embargo, se estima que la frecuencia de variantes patógenas de mtDNA en la población general es mayor, con aproximadamente 1 de cada 250 individuos sanos portadores de una variante patógena de mtDNA en niveles bajos.
La enfermedad mitocondrial puede deberse a defectos en el genoma nuclear o mitocondrial y, por lo tanto, se asocia con todos los patrones de herencia posibles: materna, autosómica dominante, autosómica recesiva, ligada al cromosoma X y de novo.
La enfermedad mitocondrial comprende una amplia gama de fenotipos clínicos debido a la doble participación de los genomas mitocondrial y nuclear, lo que a menudo hace que el diagnóstico clínico y molecular sea complejo y desafiante.
Los avances tecnológicos, en particular la Secuenciación de Nueva Generación (NGS, por sus siglas en inglés) como la Secuenciación del Exoma Completo (WES) o Secuenciación del Genoma Gompleto (WGS), han impulsado un cambio en la práctica del diagnóstico de 'primero la biopsia' a un enfoque de diagnóstico de 'primero la genómica', de ADNmt y/o ADN nuclear, o de ambos, en sangre y/u orina.
- Dado que la biopsia muscular ya no se usa ampliamente en el diagnóstico de primera línea, esta vía generalmente se aplicará si el análisis genético del ADN sanguíneo no identifica una causa o no es concluyente.
El diagnóstico tradicional de una Enfermedad Mitocondrial se ha basado en una extensa caracterización de presentaciones clínicas y evaluaciones de laboratorio mediante exámenes bioquímicos e histoquímicos de la función mitocondrial, que eran seguidos por una prueba genética.
Sin embargo, estos análisis de laboratorio a menudo muestran baja especificidad y sensibilidad, y no cuentan con pautas estandarizadas. Así, aunque pueden sugerir una enfermedad mitocondrial, no pueden descartarla, especialmente en los tejidos corporales que no se investigan. En conjunto, está claro que este enfoque, aunque completo, es costoso, lleva mucho tiempo y, lamentablemente, a menudo no es fiable ni concluyente.
Con respecto a las presentaciones clínicas, algunos pacientes pueden presentar combinaciones únicas de características que pueden agruparse en un síndrome clínico clásico (MELAS; CPEO, MERRF, etc), lo que a su vez podía guiar el análisis genético. Como esto se aplica solo a una minoría de trastornos, se ha sugerido clínicamente sospechar una Enfermedad Mitocondrial cuando se afectan simultáneamente órganos aparentemente no relacionados.
Actualmente la forma de presentación más frecuente en la práctica clínica diaria, es la mulsistémica. Las manifestaciones multisistémicas, particularmente cuando son progresivas con el tiempo, deben hacer pensar en una Enfermedad Mitocondrial Primaria, especialmente cuando involucran manifestaciones funcionales más que estructurales.
Las pruebas genéticas recomendadas van a depender del motivo de la derivación del paciente, el tipo de muestra recibida y las prestaciones del servicio de laboratorio. Esto ha llevado a la necesidad de un marco de referencia para los laboratorios involucrados en pruebas genéticas mitocondriales para facilitar un servicio consistente de alta calidad.
Las pruebas genéticas precisas y el establecimiento de un diagnóstico genético son importantes para los pacientes y sus familias, ya que brindan información sobre el pronóstico y el tratamiento, además de asesoramiento genético y acceso a opciones reproductivas. Se necesitan directrices publicadas para las pruebas genéticas de enfermedades mitocondriales, para ayudar a la comunidad europea e internacional de diagnóstico mitocondrial a lograr un servicio consistente de alta calidad.
Estas recomendaciones representan un marco de referencia de consenso recopilado por tres laboratorios altamente especializados del Servicio Nacional de Salud (NHS) del Reino Unido - London, Newcastle y Oxford- que trabajan en estrecha colaboración para ofrecer pruebas de diagnóstico para todo el país .
Motivo de la derivación y estrategias de pruebas genéticas
Las enfermedades mitocondriales son difíciles de diagnosticar debido a la heterogeneidad clínica y genética y las limitadas correlaciones genotipo-fenotipo. Por lo tanto, el diagnóstico genético efectivo a menudo requiere un enfoque multidisciplinario. Tal heterogeneidad dificulta tanto su diagnóstico como su manejo, y muchos pacientes permanecen en una odisea diagnóstica, visitando a diferentes médicos, repitiendo pruebas a veces invasivas e incluso recibiendo un diagnóstico falso o contradictorio.
- Todavía no existen tratamientos curativos para los trastornos mitocondriales, y las estrategias de tratamiento suelen basarse en aliviar los síntomas clínicos y reducir la morbimortalidad.
Pruebas moleculares en un (paciente) probando con sospecha de enfermedad mitocondrial
Existen dos enfoques/estrategias alternativas principales para las pruebas genéticas de pacientes con sospecha de enfermedad mitocondrial:
- Pruebas dirigidas a variantes de ADNmt 'comunes' y/o pruebas nucleares dirigidas - utilizando paneles de genes específicos, seguidas de pruebas más exhaustivas si es necesario y si los recursos lo permiten;
- NGS del genoma mitocondrial y/o genes nucleares, por ejemplo, mediante secuenciación del exoma completo (WES) o secuenciación del genoma completo (WGS).
Estrategias DE SECUENCIACION empleadas en el diagnóstico genético de la enfermedad mitocondrial
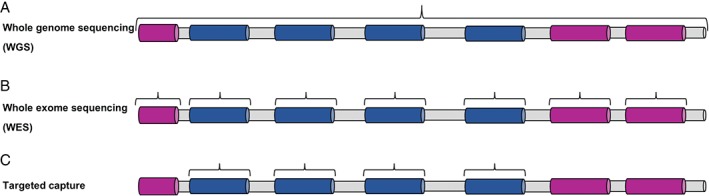
(A) WGS (secuenciación del genoma completo) analiza todas las regiones codificantes y no codificantes del genoma. (B) WES (secuenciación de todo el exoma) se dirige solo a los exones codificantes más los límites inmediatos entre intrón y exón. (C) Secuenciación dirigida a unos genes facilita la secuenciación de una región genómica predeterminada o una lista de genes de enfermedad candidatos. Las regiones no codificantes / intrónicas están sombreadas en gris, los exones de los genes candidatos están sombreados en azul y los exones de los genes no candidatos están sombreados en rosa.
Las pruebas dirigidas de primera línea de ADN en sangre pueden ser apropiadas para referencias de rutina (donde no hay una necesidad clínica urgente de obtener un diagnóstico), para presentaciones clínicas que son altamente sugestivas de una variante o gen en particular (p. ej., MELAS, MERRF, LHON, síndrome de Pearson, trastornos relacionados con POLG) y/o cuando los recursos son limitados. En pacientes en los que no se detecta una variante patogénica en la sangre, se puede sugerir información clínica adicional y muestras (p. ej., orina) o una biopsia muscular para investigaciones bioquímicas e histopatológicas. Se pueden realizar más pruebas genéticas en un enfoque gradual dependiendo de la sospecha restante de enfermedad mitocondrial.
Como alternativa, se pueden adoptar pruebas integrales basadas en NGS para pruebas genéticas de primera línea sensibles y eficientes. Este enfoque se puede seguir para todas las indicaciones de derivación, pero es particularmente apropiado para fenotipos más complejos y/o para derivaciones urgentes. Dado que tanto la enfermedad del ADNmt como la enfermedad mitocondrial nuclear representan una proporción significativa de los trastornos mitocondriales de inicio en la niñez y en la edad adulta, se recomiendan pruebas simultáneas de ADNmt y ADN nuclear si es posible.
Sin embargo, si se requiere un enfoque secuencial para reducir los costos, generalmente es más apropiado realizar pruebas de mtDNA primero debido al menor costo y el tiempo de respuesta más corto del NGS del genoma mitocondrial completo en comparación con la secuenciación de un gran panel de genes nucleares (mediante NGS basado en panel, WES o WGS).
También se está adoptando cada vez más el análisis agnóstico de genes - método para analizar los datos completos del exoma y del genoma completo sin paneles u otras ideas preconcebidas- mediante WGS/WES, para lo cual se recomienda el análisis de trío padres-probando siempre que sea posible (ya que el trío agrega datos valiosos para ayudar a la interpretación de variantes). Esto podría ser una prueba de primera línea (por ejemplo, en derivaciones pediátricas urgentes) o una prueba adicional para otras derivaciones con una fuerte sospecha clínica de enfermedad mitocondrial donde las pruebas basadas en el panel de genes no han identificado un diagnóstico.
Si bien los enfoques WGS generalmente incluyen la secuenciación profunda de todo el genoma mitocondrial (con un análisis bioinformático apropiado), un trío WES independiente del gen puede requerir NGS de ADNmt completo adicional para detectar de manera confiable el genoma mitocondrial con suficiente sensibilidad, aunque los estudios han demostrado que las lecturas fuera del objetivo de la secuenciación del exoma puede ser adecuado.
- Las lecturas fuera del objetivo pueden incluir regiones genómicas funcionalmente importantes, como promotores, secuencias no codificantes conservadas, regiones no traducidas (UTR) que pueden estar relacionadas con la patogénesis de las enfermedades mitocondriales.
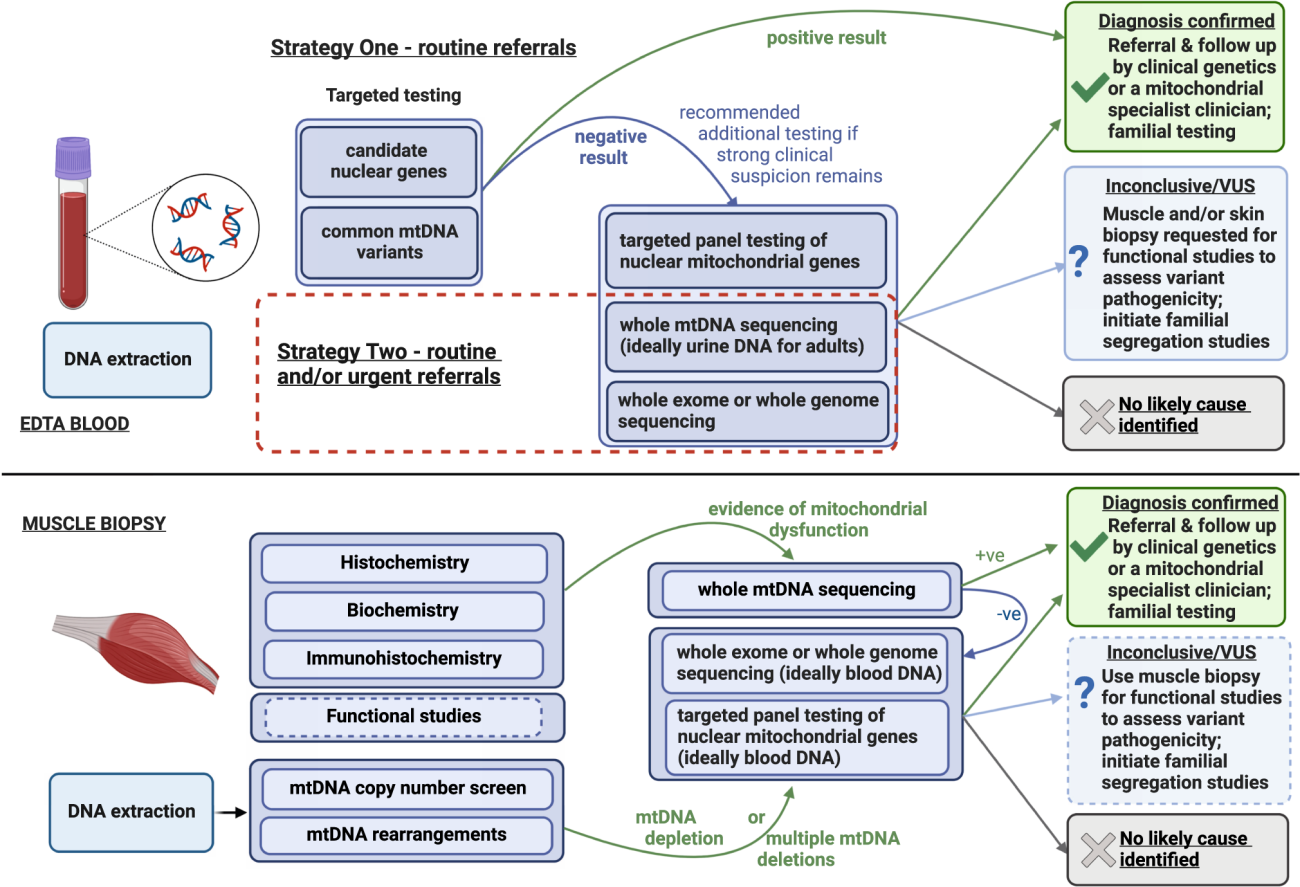
Diagrama de flujo de los algoritmos de pruebas genéticas moleculares recomendadas en derivaciones de pacientes con sospecha de enfermedad mitocondrial.
Aunque habrá algunas diferencias en las vías de las pruebas genéticas entre los centros de todo el mundo, los algoritmos del Reino Unido que se presentan aquí son ampliamente aplicables y son consistentes con las vías internacionales publicadas para la enfermedad mitocondrial de inicio en adultos.
Fenotipo/síndrome
Posibles pruebas adicionalesm.8993T>G p.(Leu156Arg)
m.8993T>C p.(Leu156Pro) ( MT-ATP6 )
+
m.3243A>G ( MT-TL1 )Cualquier
(p. ej., sangre)
Músculo > Orina > Sangre
(un resultado normal en sangre de personas ≥18 años no excluye la presencia en otro tejido)Miocardiopatía hipertrófica familiar con herencia maternaDiabetes y pérdida de audiciónPruebas de reordenamiento de mtDNA a gran escala Las pruebas
de ADN nuclear también pueden ser apropiadas Secuenciación completa de
mtDNA (p. ej., después de un examen clínico adicional)m.3243A>G
( MT-TL1 )
+
m.8993T>G p.(Leu156Arg)
m.8993T>C p.(Leu156Pro)
( MT-ATP6 )Músculo > Orina > Sangre (un resultado normal en sangre de personas ≥18 años no excluye la presencia en otro tejido)
Cualquiera
(p. ej., sangre)Hipoacusia neurosensorial no sindrómica, particularmente si comienza después de la exposición a aminoglucósidosSíndrome de Kearns-Sayre
Las pruebas de ADN nuclear también pueden ser adecuadasm.3460G>A p.(Ala52Thr)
( MT-ND1 )
m.11778G>A p.(Arg340His)
( MT-ND4 )
m.14484T>C p.(Met64Val)
( MT-ND6 )SangreMioclono, convulsiones;
Ataxia cerebelosa;
miopatíaSíndrome de PearsonN / AReordenamientos de mtDNA a gran escala (eliminaciones únicas y múltiples)
+
m.3243A>G
( MT-TL1 )Músculo > Orina > Sangre (la sangre no es adecuada en pacientes mayores de 20 años)
Músculo > Orina > Sangre
(un resultado normal en sangre de personas mayores de 18 años no excluye la presencia en otro tejido)Episodios similares a un accidente cerebrovascular, generalmente antes de los 40 añosprimero la biopsia' a un enfoque de diagnóstico de 'primero la genética', de ADNmt y/o ADN nuclear, o de ambos, en sangre y/u orinaDado que la biopsia muscular ya no se usa ampliamente en el diagnóstico de primera línea, esta vía generalmente se aplicará si el análisis genético del ADN sanguíneo no identifica una causa o no es concluyente.El diagnóstico tradicional de una Enfermedad Mitocondrial se ha basado en una extensa caracterización de presentaciones clínicas y evaluaciones de laboratorio mediante exámenes bioquímicos e histoquímicos de la función mitocondrial, que eran seguidos por una prueba genética. Estos análisis de laboratorio llevan mucho tiempo y, lamentablemente, a menudo no son fiables ni concluyentes.Se está adoptando cada vez más el análisis agnóstico de genes - método para analizar los datos completos del exoma y del genoma completo sin paneles u otras ideas preconcebidas - mediante WGS/WES, para lo cual se recomienda el análisis de trío padres-probando siempre que sea posible. Esto podría ser una prueba de primera línea (por ejemplo, en derivaciones pediátricas urgentes) o una prueba adicional para otras derivaciones con una fuerte sospecha clínica de enfermedad mitocondrial donde las pruebas basadas en el panel de genes no han identificado un diagnóstico.REFERENCIASMavraki E, Labrum R, Sergeant K, Alston CL, Woodward C, Smith C, Knowles CVY, Patel Y, Hodsdon P, Baines JP, Blakely EL, Polke J, Taylor RW, Fratter C. Genetic testing for mitochondrial disease: the United Kingdom best practice guidelines. Eur J Hum Genet . 2022 Dec 13. doi: 10.1038/s41431-022-01249-w.Watson E, Davis R, Sue CM. New diagnostic pathways for mitochondrial disease. J Transl Genet Genom2020;4:188-202. http://dx.doi.org/10.20517/jtgg.2020.31PROF. DR. FERNANDO GALAN
