INTRODUCCIÓN
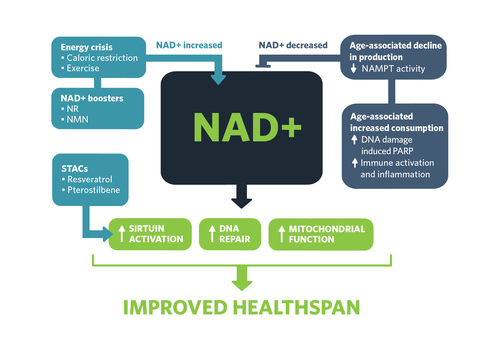
Los niveles celulares de NAD+ aumentan en condiciones de estrés energético, como restricción calórica o ejercicio; mediante la suplementación de moléculas precursoras de NAD, NR y NMN, que 'estimulan' la síntesis; o mediante compuestos activadores de sirtuína (STAC), como resveratrol o pterostilbeno. Los niveles de NAD disminuyen durante el envejecimiento debido al aumento de la actividad de NAMPT, así como a la demanda celular relacionada con la edad de reparación del ADN dirigida por PARP, función inmunológica e inflamación.
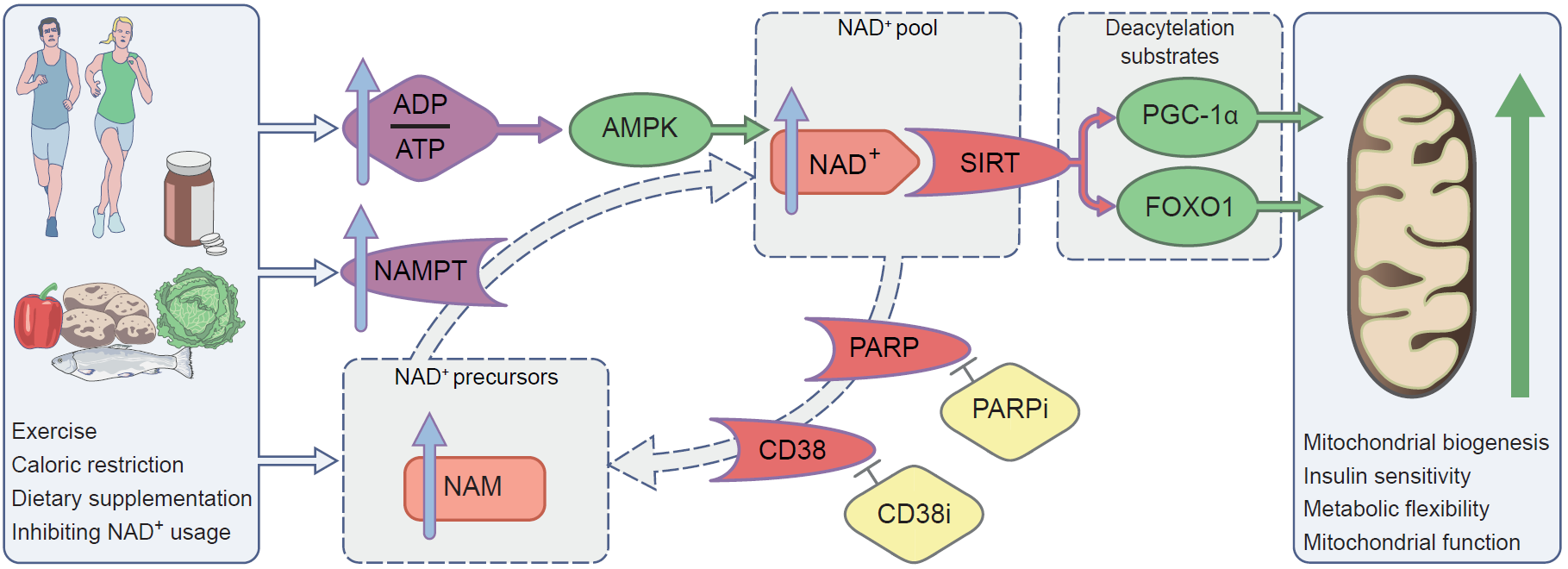
Efecto de la activación del eje NAD + / SIRT aumentando la biodisponibilidad de NAD +. Se pueden utilizar varios enfoques para aumentar la biodisponibilidad de NAD +, incluido el ejercicio, la restricción calórica, la suplementación dietética y la inhibición del consumo de NAD +. Estos cambios afectan positivamente la activación de SIRT y la posterior expresión de PGC-1α y FOXO1, lo que resulta en cambios mitocondriales y, como consecuencia, adaptaciones metabólicas. CD38i, inhibidor de CD38; FOXO1, proteína de caja de horquilla O1; NAM, nicotinamida; PARPi, inhibidor de PARP.
NUEVO DESCUBRIMIENTO
Un nuevo estudio publicado ayer en Nature, investigadores del Departamento de Fisiología de la Facultad de Medicina Perelman de la Universidad de Pensilvania y otras instituciones encontraron que el gen SLC25A51 dicta el transporte de dinucleótido de nicotinamida adenina (NAD +), una coenzima fundamental en el metabolismo celular, en las mitocondrias, donde la energía de los nutrientes se convierte en energía química para la célula. Un nivel bajo de NAD + es un sello distintivo del envejecimiento y se ha asociado con enfermedades que incluyen distrofia muscular e insuficiencia cardíaca.
Hace tiempo que se sabía que el NAD + desempeña un papel fundamental en las mitocondrias, pero la pregunta de cómo llega allí, había quedado sin respuesta.
Este descubrimiento abre una nueva área de investigación en la que realmente podemos manipular (agotar o agregar selectivamente) NAD + a nivel subcelular, ahora que sabemos cómo se transporta
El hallazgo cierra una incógnita de larga duración sobre cómo NAD + encuentra su camino hacia la matriz mitocondrial. Han estado circulando varias hipótesis, incluida la idea de que las mitocondrias de los mamíferos eran incapaces de transportar NAD +, y en cambio dependían completamente de la síntesis de NAD + dentro de la mitocondria, pero en 2018, el laboratorio de Baur descartó esa idea cuando informó en un estudio de eLife que un transportador fue de hecho responsable.
A partir de ahí, el equipo comenzó su búsqueda de la identidad genética del transportador NAD + mitocondrial de mamíferos, centrándose en varios genes, incluido el SLC25A51, que se predijo que serían transportadores, pero cuya función seguía siendo desconocida. Los miembros de la familia SLC25A codifican proteínas localizadas mitocondrialmente que transportan materiales a través de las membranas mitocondriales.
En su enfoque, se centraron en genes que se determinaron como esenciales para la viabilidad celular. NAD + es una molécula fundamental necesaria para mantener la producción de energía mediada por mitocondrias. Predijeron que la pérdida del transporte mitocondrial de NAD + interrumpiría la fosforilación oxidativa y posiblemente reduciría la supervivencia celular.
En experimentos de laboratorio, los investigadores aislaron las mitocondrias de células humanas y midieron los niveles de NAD + después de anular el SLC25A51 o sobreexpresarlo. Usando 'biosensores' de NAD + dirigidos a las mitocondrias, demostraron que un cambio en el nivel de expresión génica controla los niveles de NAD + en las mitocondrias específicamente.
Observaron que la pérdida de expresión de SLC25A51 alteró drásticamente la capacidad de las mitocondrias para consumir oxígeno y generar ATP, así como para transportar NAD + a la matriz. Además, en colaboración con el laboratorio de Cambronne, pudieron demostrar que la expresión de SLC25A51 en levaduras que carecen de sus transportadores mitocondriales endógenos NAD + restauró el transporte mitocondrial NAD +,
Los niveles de NAD + se pueden orientar en varios tratamientos de enfermedades; sin embargo, ha sido más un enfoque general, en el que los niveles aumentan o reducen en todas las partes de la célula, lo que corre el riesgo de alteraciones no intencionales de la expresión génica u otros tipos de metabolismo.
- Este estudio es el primer caso publicado in vitro en el que los investigadores identificaron un objetivo específico y redujeron los niveles únicamente en las mitocondrias y no en otras partes de la célula.
Controlar los niveles de NAD + y, por tanto, los procesos metabólicos en las mitocondrias podría tener importantes implicaciones para el estudio y desarrollo de nuevos tratamientos para enfermedades. La activación del mecanismo de transporte podría potencialmente hacer que las células favorezcan un estado de respiración para producir energía, en lugar de la glucólisis.
Un enfoque para alterar específicamente el almacenamiento o reserva de NAD + mitocondrial es algo que muchos investigadores han estado buscando, por lo que esperaría que veamos este gen dirigido a una multitud de sistemas. Esta podría ser realmente una valiosa herramienta para ayudarnos a comprender mejor la función del NAD + mitocondrial y su potencial terapéutico
¿QUÉ APORTA ESTE NUEVO DESCUBIMIENTO EXPERIMENTAL IN VITRO?
- Muestra cómo la coenzima dinucleótido de nicotinamida adenina (NAD +) encuentra su camino hacia la matriz mitocondrial, a través de gen SLC25A51 transportador.
- Y que la pérdida de expresión de SLC25A51 alteró drásticamente la capacidad de las mitocondrias para consumir oxígeno y generar ATP, así como para transportar NAD + a la matriz.
REFERENCIAS
- Davila A. et al. Nicotinamide adenine dinucleotide is transported into mammalian mitocondria. eLife. 2018; 7: e33246.
- Luongo, T.S., Eller, J.M., Lu, M. et al. SLC25A51 is a mammalian mitochondrial NAD+ transporter. Nature 2020. doi.org/10.1038/s41586-020-2741-7
PROF. DR. FERNANDO GALAN
