BREVE INTRODUCCIÓN
Hasta el 2022 se han atribuido, como causas de las Enfermedades Mitocondriales, a variantes patogénicas en más de 400 genes, tanto de origen mitocondrial como nuclear, de los aproximadamente 1500 genes que se estima que componen el proteoma mitocondrial del ADNn.
Causas de la Enfermedad mitocondrial:
- mutaciones primarias en el ADN mitocondrial: mutaciones puntuales y deleciones únicas. Herencia mitocondrial maternal
- mutaciones en el ADN nuclear: que dan como resultado defectos en las funciones de las mitocondrias, con patrón de herencia autosómico dominante, autosómico recesivo o ligado al cromosoma X, así como a deleciones múltiples o deplecion del ADN mitocondrial.
En el siguiente esquema se puede entender mejor lo referido anteriormente
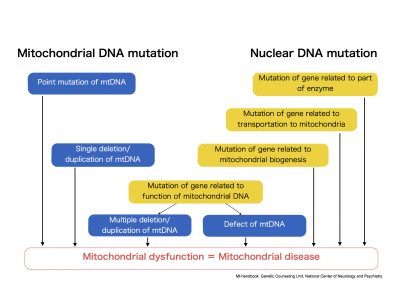
Enfermedades asociadas
m.583G>A2tRNAMT-TFDEAFm.1555A>G5tRNAMT-TVMNGIE-like disease / MELASm.1644G>A8tRNAMT-TL1MM / MELAS / SNHL / CPEOm.3256C>T11tRNAMT-TL1MMC / MELASm.3271T>C14tRNAMT-TL1m.3273delT
15
tRNA
MT-TL1
MELAS / Myopathy / Sordera + Deterioro Cognitivo
18
tRNA
MT-TL1
LHON MELAS solapamiento o superposición
21
Coding
MT-ND1
MELAS / Leigh Syndrome / LDYT / BSN
24
Coding
MT-ND1
Progressive Encephalomyopathy / Leigh Syndrome / Optic Atrophy
27
Coding
MT-ND1
CPEO / MS. características clínicas tanto de la oftalmoplejía externa crónica progresiva como de la esclerosis múltiple
30
tRNA
MT-TI
Encephalopathy / MELAS
33
tRNA
MT-TW
Leigh Syndrome
36
tRNA
MT-TN
CPEO / MM
39
Coding
MT-CO1
SNHL
42
tRNA
MT-TS1
SNHL
45
tRNA
MT-TK
MNGIE / Progressive mito cytopathy
48
tRNA
MT-TK
MERRF
51
Coding
MT-ATP8/6
BSN / Leigh syndrome
54
Coding
MT-ATP6
NARP / Leigh Disease / MILS / other
57
Coding
MT-ATP6
FBSN / Leigh Disease
60
Coding
MT-ATP6
Encephalopathy / Seizures / Lacticacidemia
PEM
64
Coding
MT-ND3
Leigh Disease / Dystonia / Stroke / LDYT
67
Coding
MT-ND4
LHON / Progressive Dystonia
70
tRNA
MT-TH
DMDF / RP+SNHL
73
tRNA
MT-TL2
CPEO / KSS / possible carotid atherosclerosis risk, trend toward myocardial infarction risk
76
Coding
MT-ND5
Optic neuropathy/ retinopathy/ LD
79
Coding
MT-ND5
LHON
82
Coding
MT-ND5
LDYT / Leigh Disease / dystonia / carotid atherosclerosis risk
85
Coding
MT-ND6
LHON
88
Coding
MT-ND6
LHON
91
tRNA
MT-TE
Encephalomyopathy + Retinopathy
94
Coding
MT-CYB
MM / PEO
iagnóstico adicional en el 10 % de los pacientes con sospecha de enfermedad mitocondrial.
El rendimiento diagnóstico es superior con la técnica secuenciación del genoma completo (WGS) que con la secuenciación del exoma completo (WES), y es el resultado de su capacidad no solo para identificar las variantes de diagnóstico detectables por WES sino también para detectar variantes de diagnóstico más allá del alcance de WES. La ventaja de usar WGS en lugar de WES fue que es más fácil detectar variantes del número de copias (CNV), expansiones repetidas y heteroplasmias de bajo nivel. Porque WES no los detecta.
- WGS (secuenciación del genoma completo) analiza todas las regiones codificantes y no codificantes del genoma.
- WES (secuenciación de todo el exoma) se dirige solo a los exones codificantes más los límites inmediatos entre intrón y exón.
- La captura de genes: facilita la secuenciación de una lista de genes de enfermedades candidatos
Con el tiempo, mejorará la capacidad de interpretar intrónicos profundos y otras variantes de WGS no codificantes, aumentando así la ventaja diagnóstica de WGS sobre WES. Nuestra predicción, por lo tanto, es que las desventajas percibidas de WGS en relación con WES, incluido el aumento de costos y mayores requisitos para el análisis y almacenamiento de datos, serán finalmente superadas por su superioridad diagnóstica.
Los estudios genéticos clínicos de rutina en el diagnóstico de enfermedad mitocondrial en grandes cohortes tienen un rendimiento diagnóstico más bajo (34,5-39 %), lo que se cree que refleja más la práctica clínica diaria.
El enfoque actual para el diagnóstico de enfermedad mitocondrial, incluso con poca sospecha, es estudiar mutaciones del mtDNA mediante WES o un panel de genes mitocondriales específicos, actualmente 96 mutaciones. Y si fuera negativo, estudiar mutaciones el ADN nuclear mediante WGS.
Por lo tanto, muchos médicos que practican la medicina mitocondrial se preguntan ¿sí la biopsia muscular sigue siendo el estándar de oro para el diagnóstico de la enfermedad mitocondrial? NO LO ES. Los estudios de biopsia muscular solo deben utilizarse en situaciones clínicamente urgentes o para confirmar un resultado genético no concluyente.
Además, los defectos en el mantenimiento mitocondrial, fusión / fisión, traducción, transcripción o anomalías en la integridad o el transporte de la membrana mitocondrial nos han enseñado que algunos de estos trastornos NO siempre se presentan con deficiencias significativas de OXPHOS y pueden presentarse con resultados bioquímicos e histológicos musculares normales.
CONCLUSIONES
- El enfoque inicial actual para el diagnóstico de enfermedad mitocondrial, INCLUSO CON BAJA SOSPECHA, ES GENÉTICO. SOSPECHAR una enfermedad mitocondrial en EDAD PEDIÁTRICA con estos síntomas iniciales inespecíficos como: retraso en el desarrollo, debilidad muscular y epilepsia. Y SOSPECHAR una enfermedad mitocondrial EN ADULTOS en adultos con estos síntomas iniciales inespecíficos como: debilidad muscular, cansancio crónico e intolerancia al ejercicio.
- ODISEA DIAGNÓSTICA: estos pacientes generalmente acuden a medicina general y medicina familiar– si no se les ha colocado ya la etiqueta por algún médico de la Seguridad Social o privado de padecer DEPRESIÓN, FIBROMIALGIA, SINDROME DE FATIGA CRÓNICA o SÍNDROME DEL DOLOR CENTRAL – son remitidos al Servicio de Neurología y dentro de este, a la sección de Enfermedades Neuromusculares. Donde algunos de los distintos especialistas, no les reciben con especial atención porque se refugian en que es una enfermedad que no tiene cura y como mucho les hacen un hemograma, un perfil bioquímico y análisis basal de lactato, un EMG y después quizá una biopsia muscular.
- El diagnóstico de la enfermedad mitocondrial se ha basado tradicionalmente en una biopsia de tejido invasiva para el análisis bioquímico e histoquímico, QUE PUEDE SER NORMAL INCLUSO EN PACIENTES CON UN DIAGNOSTICO GENÉTICO DEFINIDO.
- Muchos médicos que practican la medicina mitocondrial se preguntan - SÍ LA BIOPSIA MUSCULAR SIGUE SIENDO EL ESTÁNDAR DE ORO PARA EL DIAGNÓSTICO DE LA ENFERMEDAD MITOCONDRIAL. PUES NO LO ES. Los estudios de biopsia muscular solo deben utilizarse en situaciones clínicamente urgentes o para confirmar un resultado genético no concluyente.
REFERENCIA
- Saneto RP. Mitochondrial diseases: expanding the diagnosis in the era of genetic testing. J Transl Genet Genom 2020;4:[Online First]. http://dx.doi.org/10.20517/jtgg.2020.40
- Gusic M, Prokisch H. Genetic basis of mitochondrial diseases. FEBS Lett. 2021 Apr;595(8):1132-1158. doi: 10.1002/1873-3468.14068. Epub 2021 Mar 21. PMID: 33655490.
- Alston CL, Stenton SL, Hudson G, Prokisch H, Taylor RW. The genetics of mitochondrial disease: dissecting mitochondrial pathology using multi-omic pipelines. J Pathol. 2021 Jul;254(4):430-442. doi: 10.1002/path.5641. Epub 2021 Mar 26. PMID: 33586140; PMCID: PMC8600955.
PROF. DR. FERNANDO GALAN
