En un carta al editor de The New England Journal of Medicine (NEJM) del 16 de mayo de 2019, de Sarah J. Pickett y colaboradores pertenecientes a Newcastle University, Newcastle Upon Tyne, United Kingdom, han reportado los resultados de un estudio llevado a cabo en 183 parejas de madres e hijos con la mutación m.3243A> G:
- 67 de la cohorte de pacientes del Reino Unido con enfermedades mitocondriales
- 116 parejas de madres e hijos publicadas anteriormente.
Una de las principales ventajas de los avances recientes en el diagnóstico genético de la enfermedad mitocondrial ha sido la oportunidad de brindar asesoramiento genético a las familias con enfermedad mitocondrial.
Para las familias con mutaciones de ADNmt, el asesoramiento genético es complicado.
Por aspectos singulares de la genética mitocondrial:
- La heteroplasmia de mtDNA (es decir, la mezcla de mtDNA mutado [patógeno] y de tipo salvaje (normal) dentro de una célula)
- El efecto de umbral (es decir, el nivel de carga de mutación del ADNmt por debajo del cual no surgen síntomas de la enfermedad)
- El cuello de botella genético mitocondrial (es decir, el proceso que puede llevar a que la descendencia nazca con un rango de diferentes cargas de mutación)
Recuerdo de conceptos
Homoplasmia: mitocondrias que contienen sólo una población pura de mtDNA normal o una población pura de mtDNA mutante
Heteroplasmia: mezcla de mitocondrias, unas con y otras sin mutación
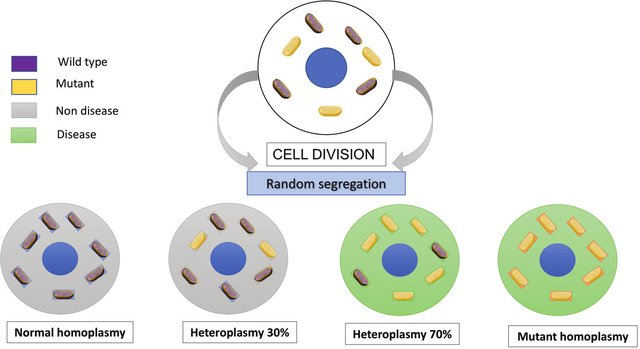
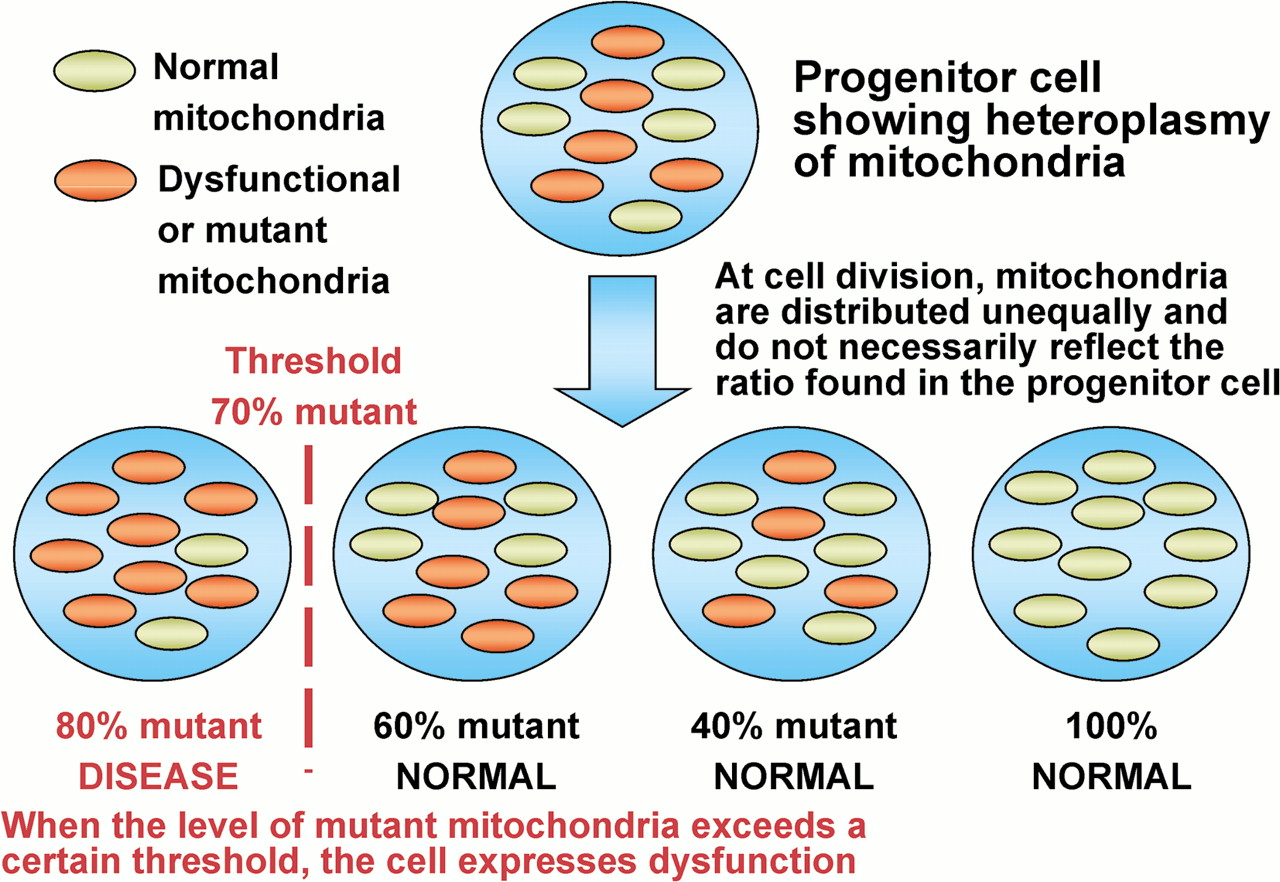
Efecto de umbral: nivel de carga de mutación del ADNmt por debajo del cual no surgen síntomas de la enfermedad
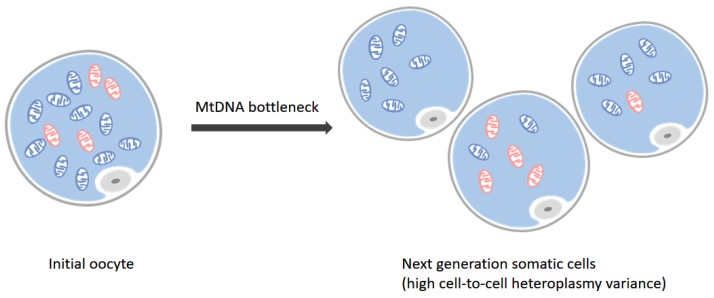
Efecto de cuello de botella. Hay dos tipos de ADNmt en el ovocito inicial (izquierda), donde el azul representa mitocondrias que albergan el ADNmt de tipo salvaje (normal) y los rojos representan los mutados. Durante la meiosis que actúa bajo el efecto del cuello de botella del ADNmt, las mitocondrias en las células somáticas de próxima generación toman una situación de alta varianza heteroplasmática de célula a célula (derecha). Algunos de ellos pueden albergar todos los ADNmt de tipo salvaje (normal), mientras que otros acumulan una o más mutaciones
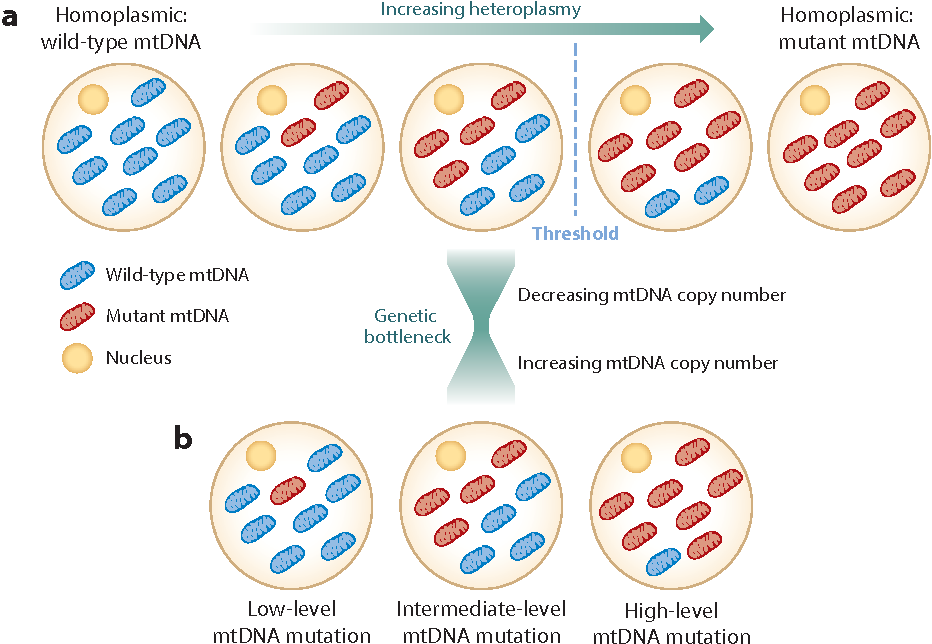
El ADN mitocondrial (ADNmt) es heteroplásmico, el efecto umbral y el cuello de botella mitocondrial.
- La mayoría de las mutaciones de ADNmt patógenas son heteroplásmicas, con células individuales que tienen diferentes proporciones de ADNmt mutante y de tipo salvaje (normal). El aumento de los niveles de heteroplasmia a menudo se asocia con el aumento de la gravedad de la enfermedad mitocondrial. Por lo general, la célula puede tolerar altos niveles de ADNmt mutante, y se debe superar un umbral crítico antes de que se detecte un defecto bioquímico en la cadena respiratoria.
- Este nivel de umbral depende de la mutación del ADNmt, pero generalmente se cree que está entre el 60% y el 80%.
- Se cree que el cuello de botella genético mitocondrial implica la transmisión de un número restringido de moléculas de ADNmt durante el desarrollo de la línea germinal femenina, seguido de la amplificación del ADNmt que puede dar como resultado que los ovocitos humanos contengan> 100,000 copias de ADNmt. La presencia del cuello de botella puede dar lugar a ovocitos que contienen niveles muy diferentes de heteroplasmia en comparación con los niveles de la madre, lo que dificulta el asesoramiento genético.
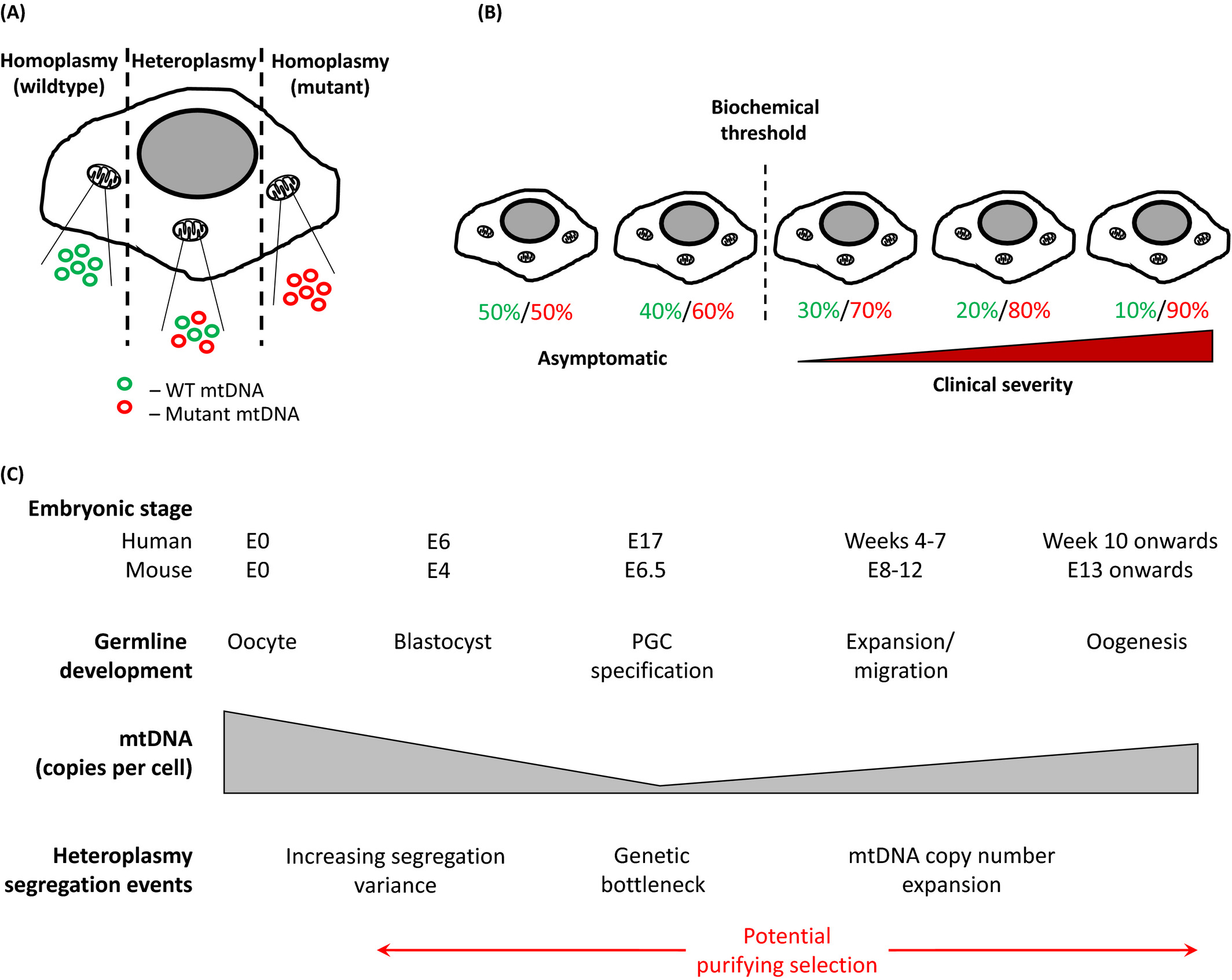
El ADNmt heteroplasmático y su transmisión a través de la línea germinal femenina.
- Cada célula contiene múltiples moléculas de ADNmt, una mutación en el ADNmt (círculos rojos) se denomina homoplásmica si todas las copias portan la mutación, o heteroplásmica si solo una proporción la porta.
- En las células heteroplásmicas, a medida que aumenta la carga de una mutación patógena (cifras rojas) en comparación con el ADNmt de tipo salvaje - normal (cifras verdes), se alcanza un umbral bioquímico. Más allá de este punto, la célula ya no puede compensar la mutación y se desarrolla un defecto en la cadena respiratoria. La gravedad de este defecto tiende a empeorar con un aumento adicional en los niveles de ADNmt mutante.
- Representación esquemática del desarrollo de la línea germinal femenina durante la embriogénesis, y eventos asociados que determinan la segregación diferencial de variantes de ADNmt heteroplásmicas. Si bien la contribución de la selección purificadora a este proceso es controvertida, dichos mecanismos podrían activarse a partir de la disminución inicial en el número de copias del ADNmt celular que conduce al cuello de botella genético, durante la especificación y el desarrollo de PGC y mediante la ovogénesis a la vida adulta.
CONTINUAMOS
Las mutaciones de MtDNA son puramente transmitidas maternalmente. Cada célula puede contener de varios cientos a miles de copias de ADNmt. Una peculiaridad de muchas mutaciones de ADNmt patógenas es el concepto de heteroplasmia de ADNmt y la presencia de un cuello de botella genético durante el desarrollo conduce a una descendencia que puede tener niveles notablemente diferentes de heteroplasmia en comparación con la madre.
Las mujeres que portan variaciones patógenas del ADN mitocondrial (ADNmt) corren el riesgo de transmitir altos niveles de estas variaciones a sus hijos; para tales mujeres hay una variedad de opciones reproductivas. Algunas mujeres pueden optar por no tener sus propios hijos (no tener hijos voluntariamente), otras adoptar o usar la donación de óvulos. Otras mujeres pueden optar por reproducirse naturalmente y esperar un resultado exitoso, mientras que otras considerarán el diagnóstico prenatal con la opción de terminar los embarazos afectados.
Para evaluar el riesgo de transmisión de la enfermedad, se centraron en la mutación MT-TL1 m.3243A → G (debido a que los patrones de herencia son específicos de la mutación), la variante patógena del ADNmt heteroplásmica más común asociada con la enfermedad del ADNmt grave (transmitida por aproximadamente un tercio de adultos en nuestras clínicas mitocondriales).
- Los niños con niveles de heteroplasmia no superiores al 18%, se asocia con una probabilidad del 95% o más de no ser afectado clínicamente.
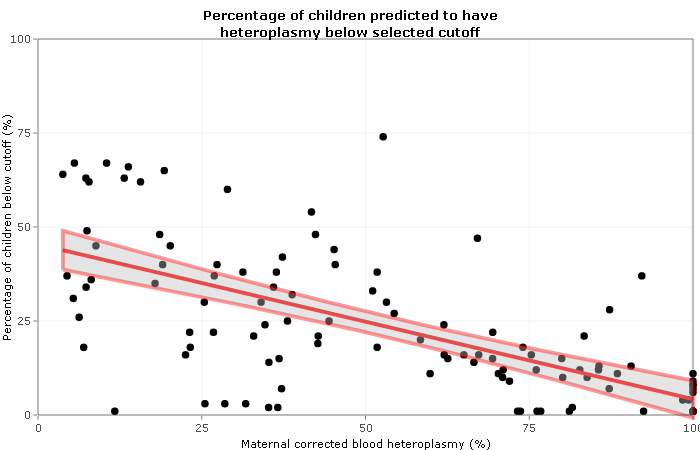
Porcentaje de niños que se pronostica que tendrán un 18% o menos heteroplasmia para una heteroplasmia materna
Herramienta web interactiva que pronosticará las proporciones de niños en diferentes niveles de heteroplasmia materna para un umbral especificado por el usuario, (http://www.newcastle-mitochondria.com/m3243agheteroplasmy-levels-in-children/)
- Solo una cuarta parte de los niños nacidos de madres, que albergan una carga del 50% de heteroplasmia de la mutación m.3243A → G, tienen niveles de heteroplasmia de 18% o menos.
- Para las madres con niveles de heteroplasmia de 90% o más, el porcentaje de niños con 18% o menos de heteroplasmia es solo del 8%. La variabilidad sustantiva en la transmisión biológica, indicada por los muchos puntos fuera de los intervalos de predicción, es también un hallazgo de relevancia en el asesoramiento de las mujeres afectadas y las deliberaciones de los reguladores.
Sus datos muestran que el riesgo de tener un hijo clínicamente afectado se puede predecir sobre la base del heteroplasma materno m.3243A → G. Para algunas mujeres, el número de ovocitos necesarios para producir un embrión con una carga de mutación suficientemente baja (≤18%), y por lo tanto la posibilidad de un niño sano, puede ser prohibitivamente alto para el diagnóstico genético de preimplantación 'exitoso', uno que resulte en el el nacimiento de un niño sano que tiene un riesgo mínimo de enfermedad de ADNmt.
CONCLUSIONES
- Para las familias con mutaciones de ADNmt, el asesoramiento genético es complicado, por los siguientes motivos: heteroplasmia de mtDNA, efecto de umbral y el cuello de botella genético mitocondrial
- Los niños con niveles de heteroplasmia no superiores al 18%, se asocia con una probabilidad del 95% o más de no ser afectado clínicamente
- Solo una cuarta parte de los niños nacidos de madres, que albergan una carga del 50% de heteroplasmia de la mutación m.3243A → G, tienen niveles de heteroplasmia de 18% o menos.
- Para las madres con niveles de heteroplasmia de 90% o más, el porcentaje de niños con 18% o menos de heteroplasmia es solo del 8%.
REFERENCIAS
- Pickett SJ, Blain A, Wilson IJ, Taylor RW, McFarland R, Turnbull DM, Gorman GS. Mitochondrial Donation — Which Women Could Benefit?. N Engl J Med 2019;380:1971-1972
- Craven L, Alston CL, Taylor RW, Turnbull DM. Recent Advances in Mitochondrial Disease. Annu Rev Genomics Hum Genet. 2017;31;18:257-275.
RESUMEN Y COMENTARIOS: PROF. DR. FERNANDO GALAN
