La sensibilidad a los alimentos, no es un término médico, sino un término de MARKETING que a menudo se aplica a una variedad de síntomas sin evidencia que respalde su uso. En Internet encontrará muchas empresas que comercializan pruebas de sensibilidad a los alimento. No hay pruebas validadas para diagnosticar la sensibilidad a los alimentos.
Por lo tanto, las pruebas de IgG carecen de especificidad para la intolerancia alimentaria y no miden ningún marcador clínicamente válido. Más evidencia de esta relación entre la IgG elevada y la tolerancia inmunológica es el hecho de que, en la alergia alimentaria mediada por IgE, los anticuerpos IgG suelen ser bajos, no altos. Algunas investigaciones han propuesto que las pruebas de IgG se pueden usar junto con las pruebas de alergia alimentaria de IgE;
- sin embargo, como herramienta de diagnóstico, las pruebas de IgG en esta circunstancia no agregan ninguna información y son superfluas.
Además, la investigación de una gran población muestra una amplia variación entre la exposición a un alimento y los síntomas reales que se correlacionan con niveles elevados de IgG. Los niveles de IgG también están elevados en personas sanas que por lo demás no presentan síntomas.
- Una vez más, esto refleja que la elevación de IgG de hecho representa tolerancia inmunológica y puede ser simplemente un reflejo de una exposición reciente a un alimento.
Otro punto, que proporciona el último clavo en el ataúd para cualquier supuesta validez de las pruebas de IgG para intolerancias alimentarias, se relaciona con el hecho de que la IgG elevada, puede ser simplemente un reflejo de una exposición reciente a un alimento.
Otro mito del diagnóstico de alergias alimentarias es que las pruebas de IgG específicas de los alimentos tienen un papel en la identificación de las sensibilidades a los alimentos o deben usarse para evitar alimentos. Muchas empresas ofrecen esta moda pasajera o incluso la comercializan directamente a los consumidores sin tener que ver a un médico. Las Asociaciones nacionales de alergia, como la Sociedad Canadiense de Alergia e Inmunología Clínica (CSACI) y la Academia Estadounidense de Alergia, Asma e Inmunología (AAAAI), han criticado sistemáticamente las pruebas de IgG para la alergia alimentaria por no ser válidas para la evaluación de esta afección.
La CSACI, en una declaración de posición sobre las pruebas de IgG, señaló que "desaconseja enérgicamente la práctica de pruebas de IgG específicas de alimentos con el fin de identificar o predecir reacciones adversas a los alimentos".
No hay evidencia de que las pruebas de IgG marquen la sensibilidad a los alimentos; de hecho, la presencia de IgG es esperable y es un indicador potencial de tolerancia a dicho alimento. Se han planteado preocupaciones de que el uso de esta prueba resulte en restricciones dietéticas innecesarias que pueden empeorar la calidad de vida y conlleva un costo financiero significativo para la familia.
Un sentimiento similar fue expresado por la Academia Europea de Alergia e Inmunología Clínica, y respaldado por la AAAAI, en un informe que establece que la prueba de IgG es "irrelevante" para el diagnóstico de alergia o intolerancia alimentaria y "no debe realizarse en caso de molestias relacionadas con alimentos".
Cita de la conclusión del informe del grupo de trabajo de la Academia Europea de Alergia e Inmunología Clínica (EAACI):
"La IgG4 específica de los alimentos no indica alergia o intolerancia alimentaria (inminente), sino una respuesta fisiológica del sistema inmunitario después de la exposición a los componentes de los alimentos. Por lo tanto, la prueba de IgG4 a los alimentos se considera irrelevante para el análisis de laboratorio de alergias o intolerancias alimentarias y no debe realizarse en caso de quejas relacionadas con los alimentos”
- Las pruebas de IgG nunca deben considerarse en el estudio de la alergia alimentaria.
Una reacción adversa a los alimentos es un término general para cualquier respuesta adversa a la ingestión de un alimento.
En un metanálisis de pacientes que informaron reacciones adversas a los alimentos, el 35 % de los sujetos autoinformaron alergia alimentaria (AF), mientras que solo el 3,5 % de los pacientes alcanzaron un diagnóstico de alergia alimentaria confirmado por prueba de provocación alimentaria oral
- El 50% de las alergias alimentarias autoinformadas pueden ser falsas
- Hasta el 60% de las personas que padecen alergias alimentarias pueden recibir un diagnóstico erróneo.
Aclarando los conceptos de alergia a los alimentos e intolerancia a los alimentos
Tipos de reacciones adversas a los alimentos
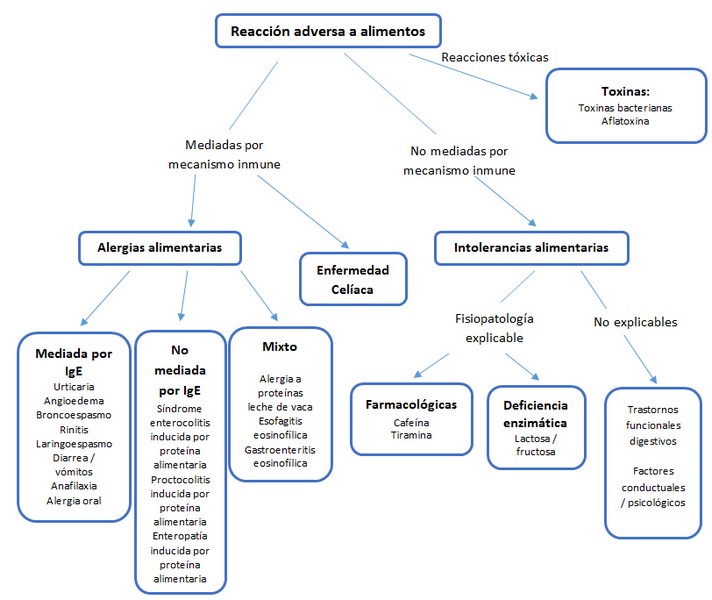
Una reacción adversa a los alimentos se clasifica según haya o no un mecanismo inmune subyacente:
- Alergia alimentaria: es una respuesta adversa, mediada por el sistema inmune, que ocurre tras la exposición a un alimento. Esta respuesta inmune puede clasificarse en:
- Mediada por IgE específica: Es la más común y ocurre cuando el cuerpo produce anticuerpos IgE en respuesta a una proteína alimentaria en particular. Estas reacciones pueden ser inmediatas, entre minutos y horas después de la ingestión, o retardadas, entre 6 y 8 horas o incluso días después. Los síntomas pueden variar de leves (urticaria, picazón, hinchazón) a severos (anafilaxia, es decir, dificultad para respirar o tragar) requiere que haya una sensibilización previa a un alérgeno alimentario (que desarrollará IgE específico) y la aparición de signos y síntomas tras la exposición a la comida
- IgE mixto y no IgE: Las reacciones adversas alimentarias mixtas IgE y no IgE presentan síntomas que se manifiestan tanto en reacciones mediadas por IgE como no mediadas por IgE.
- No mediada por IgE: en este caso el mecanismo inmune subyacente está mediado por células T y para su diagnóstico es necesario que haya cambios histológicos secundarios a este mecanismo inmune.
- Intolerancia alimentaria: es una respuesta adversa a la ingestión de un alimento en la que no existe un mecanismo inmune que la justifique. Se presentan principalmente con síntomas gastrointestinales (GI) debido a la dificultad con la digestión, que incluyen dolor abdominal, distensión abdominal, estreñimiento o diarrea. Los síntomas pueden aparecer y desaparecer con el tiempo y pueden variar según el tipo y la cantidad de alimentos ingeridos. El ejemplo más común es la intolerancia a la lactosa.
- o bien no tener una explicación mediante un proceso orgánico como en las múltiples intolerancias alimentarias que describen los pacientes con patología funcional digestiva (dispepsia, síndrome intestino irritable).
No hay pruebas validadas o basadas en evidencia disponibles para diagnosticar intolerancias alimentarias. En cambio, este diagnóstico generalmente requiere la eliminación de los alimentos sospechosos de la dieta, el control de la resolución de los síntomas y luego la reintroducción de los alimentos para ver si los síntomas regresan. Esto puede tomar semanas o meses y puede ser un proceso difícil.
|
INTOLERANCIA ALIMENTARIA |
ALERGIA ALIMENTARIA |
SENSIBILIDAD ALIMENTARIA* |
|
Deficiencia enzimática |
Inmune mediada por (IgE) |
Inmune (IgG) falso |
|
Poco después del consumo |
Inmediata |
|
|
Trastornos digestivos Los síntomas pueden ser inconvenientes e incómodos, pero no ponen en peligro la vida. Los síntomas gastrointestinales de una intolerancia alimentaria suelen aparecer en unas pocas horas e incluyen: Diarrea. Gases e hinchazón. Acidez. Náuseas. Dolor de estómago. Dolor de barriga |
Picazón, hinchazón, enrojecimiento, tos, náuseas y vómitos. Anafilaxia a los alimentos ocurre con la reexposicion a un alérgeno. La incidencia de anafilaxia mortal (relacionada con los alimentos) fue de 1,81 por millón de años-persona, que es inferior a la incidencia de muerte accidental entre los europeos en general. El tratamiento de primera línea de la anafilaxia es la epinefrina y nunca los antihistamínicos
|
Es falso que las pruebas de IgG específicas de los alimentos tienen un papel en la identificación de las sensibilidades a los alimentos o deben usarse para evitar alimentos. La IgG elevada no refleja sensibilidad a un alimento, sino que refleja exposición al alimento (o compuesto en ese alimento). Por lo tanto, un resultado de prueba de IgG elevado puede indicar simplemente que ha comido ese alimento, y no que sea intolerante a él. De hecho, la IgG elevada se asocia con tolerancia inmunológica, no con intolerancia |
|
Ocurrirá cada vez que se consuma alimento. |
Ocurrirá cada vez que se consuma alimento. |
* Sensibilidad a los alimentos, no es un término médico sino un término de marketing que a menudo se aplica a una variedad de síntomas sin evidencia que respalde su uso. En Internet encontrará muchas empresas que comercializan pruebas de sensibilidad a los alimento.
Alergia alimentaria mediada por IgE específica
Las pruebas diagnósticas de alergia de primera línea son pruebas cutáneas por punción, pruebas serológicas de IgE específica para alimentos (sIgE) o ambas. Aunque tanto las pruebas cutáneas por punción como las pruebas de IgE específicas para alimentos son muy sensibles (>90 % para las pruebas cutáneas por punción, 70 %-90 % para sIgE), la especificidad y los valores predictivos positivos de las pruebas suelen ser muy bajos.
- La tasa de pruebas falsas positivas es de hasta un 40%.
Las pruebas en sí mismas son muy buenas para detectar sIgE si está presente, pero su presencia no es patognomónica de alergia clínica, y es difícil comprender la importancia de lo que significa sIgE aislada sin el contexto de una sospecha de reacción al alimento en cuestión.
Si solo nos basamos en las pruebas de IgE, vamos a sobrediagnosticar a la gran mayoría de las personas con alergias alimentarias que en realidad no tienen. La alergia alimentaria se diagnostica por la historia clínica y luego se confirma mediante pruebas
Un elemento central para el diagnóstico preciso de una ALERGIA ALIMENTARIA es una historia clínica sólida centrada en la alergia. La información específica sobre los síntomas de presentación debe incluir lo siguiente:
- la edad de inicio de los síntomas;
- el momento del inicio después del contacto con alimentos;
- la duración, gravedad y frecuencia de los síntomas;
- y la cantidad de alimento necesaria para inducir una reacción,
- así como la reproducibilidad de los síntomas en la reexposición.
Otra información pertinente incluye
- antecedentes personales de enfermedades atópicas (otras AF, asma, eccema o rinitis alérgica); antecedentes familiares de enfermedad atópica en padres o hermanos;
- factores culturales y religiosos que afectan las preferencias alimentarias;
- evaluación dietética integral, incluida la edad de destete y las preferencias alimentarias; y si son amamantados, mixtos o alimentados con fórmula. Si la persona es amamantada, indagar sobre la ingesta dietética materna; detalles de cualquier tratamiento anterior, incluidos medicamentos como antihistamínicos; y detalles sobre la eliminación y reintroducción de alimentos que pueden guiar una mayor investigación y gestión.
- Un "diario de alimentos y síntomas de 14 días" es una valiosa ayuda para el diagnóstico.
No hay sustituto para un historial médico completo Entonces, ¿qué podemos hacer?
- No solicite pruebas de IgE alimentaria para detectar alergias alimentarias, si el paciente no tiene síntomas.
- No recomiende las pruebas de sensibilidad a los alimentos, sino que aliente a los pacientes a llevar un diario de alimentos y síntomas. Pueden considerar usar el dinero que ahorraron para cubrir el costo de una visita con un dietista.
- Sea curioso. Escuche la historia de tu paciente: Es su experiencia vivida. No lo descarte. Si no sabe qué está causando sus síntomas, sea honesto con ellos.
AUMENTO DEL AUTODIAGNÓSTICO POR INTERNET DE INTOLERANCIAS A LOS ALIMENTOS CON COSTOSAS PRUEBAS NO VALIDADAS NI RECOMENDADAS
Es importante tener en cuenta que el aumento del autodiagnóstico se ha producido en el contexto de un aumento reciente en la popularidad de las costosas pruebas de "intolerancia alimentaria", afirman FALSAMENTE identificar alergias o intolerancias alimentarias "ocultas", que causan o contribuyen a cualquier constelación de condiciones como:
- Síndrome de Fatiga Crónica, Síndrome del Intestino Irritable (SII), dolor de cabeza, hiperactividad, congestión y problemas de sinusitis, artritis y casi cualquier síntoma mental.
Si pasa algún tiempo buscando información sobre reacción adversa a los alimentos en línea, sin duda descubrirá sitios que afirman que tiene alergias o intolerancias alimentarias "ocultas". Nombra tus dolencias crónicas, es decir, dolores de cabeza, hinchazón, acné, incluso confusión mental, y puedes encontrar afirmaciones de que los alimentos son los culpables.
Muchos de estos sitios ofrecerán enviarle un kit y recolectar su cabello, sangre u otra muestra, y analizarla para revelar sus intolerancias alimentarias "ocultas". Estos kits se promocionan como una forma conveniente de probar la intolerancia a cientos de alimentos a la vez. Incluso son promocionados en las redes sociales por algunas de sus celebridades.
Desafortunadamente, en Internet encontrará muchas empresas que comercializan pruebas de sensibilidad a los alimentos y hay muchos sitios web y profesionales que reclaman la alternativa, mientras que a veces afirman que los médicos tradicionales simplemente no entienden. También hacen afirmaciones dudosas de que varias pruebas de intolerancia alimentaria están disponibles para diagnosticar intolerancias alimentarias, a pesar de la falta de evidencia que demuestran que estas pruebas sean válidas, dan como resultado diagnósticos inexactos o, en última instancia, NO ayudan a mejorar los síntomas. No es sorprendente que muchos de los mismos sitios que ofrecen afirmaciones no basadas en evidencia también estén muy dispuestos a recaudar dinero para sus kits de prueba.
CONCLUSIONES
- La sensibilidad a los alimentos, no es un término médico, sino un término de MARKETING que a menudo se aplica a una variedad de síntomas sin evidencia que respalde su uso.
- No hay evidencia de que las pruebas de IgG marquen la sensibilidad a los alimentos; de hecho, la presencia de IgG es esperable y es un indicador potencial de tolerancia a dichos alimentos.
- La Sociedad Canadiense de Alergia e Inmunología Clínica (CSACI), en una declaración de posición sobre las pruebas de IgG, señaló que "desaconseja enérgicamente la práctica de pruebas de IgG específicas de alimentos con el fin de identificar o predecir reacciones adversas a los alimentos".
- Si solo nos basamos en las pruebas de IgE, sin una historia clínica sólida, vamos a sobrediagnosticar a la gran mayoría de las personas con alergias alimentarias que en realidad no tienen. Siendo las pruebas falsas positivas de hasta un 40%.
- El último clavo en el ataúd para cualquier supuesta validez de las pruebas de IgG para intolerancias alimentarias, se relaciona con el hecho de que la IgG elevada, puede ser simplemente un reflejo de una exposición reciente a un alimento.
- El aumento del autodiagnóstico mediante costosas pruebas de intolerancia alimentaria, afirman FALSAMENTE identificar alergias o intolerancias alimentarias "ocultas", que causan o contribuyen a cualquier constelación de condiciones como: Síndrome de Fatiga Crónica, Síndrome del Intestino Irritable (SII), dolor de cabeza, hiperactividad, congestión y problemas de sinusitis, artritis y casi cualquier síntoma mental.
REFERENCIAS
- Abrams EM, Greenhawt M, Shaker M, Alqurashi W. Separating Fact from Fiction in the Diagnosis and Management of Food Allergy. J Pediatr. 2022;241:221-228. doi:10.1016/j.jpeds.2021.10.011
- Staats J, Van Zyl I. Adverse reactions to food: Navigating the maze in primary health care. S Afr Fam Pract (2004). 2022;64(1):e1-e5. Published 2022 Jul 21. doi:10.4102/safp.v64i1.5530
- Hammond C, Lieberman JA. Unproven Diagnostic Tests for Food Allergy. Immunol Allergy Clin North Am. 2018;38(1):153-163. doi:10.1016/j.iac.2017.09.011
PROF. DR. FERNANDO GALAN
APÉNDICE
Se han promovido varias pruebas engañosas para diagnosticar alergias e intolerancias alimentarias, sin ninguna evidencia creíble y con un costo significativo, ya que estas pruebas NO son reconocidas por el Sistema Nacional de Salud. Estas pruebas no solo carecen de fundamento científico, sino que se ha demostrado que son inexactas y poco confiables en estudios publicados.
Pruebas de diagnóstico no probadas
- Kinesiología Aplicada (Pruebas Musculares)
- Pruebas de citotoxicidad
- Prueba Electrodérmica (Prueba Vega)
- Técnicas de eliminación de alergias de Nambudripad (NAET), también conocido como tratamiento de eliminación natural de alergias (NEAT)
- Pruebas de IgG/IgG4
- Análisis del cabello
- Prueba de pulso
Otras pruebas no probadas y no estandarizadas según lo señalado por las pautas del NIAID incluyen:
- Liberación/activación de histamina de basófilos
- estimulación de linfocitos
- Termografía facial
- Análisis de jugo gástrico
- Provocación endoscópica de alérgenos
- Neutralización de la provocación
- Ensayo de liberación de mediador