Fernando Galán Galán
Profesor Titular de Medicina
Especialista en Medicina Interna
Experto en Miopatía Mitocondrial del Adulto
Fibromialgía y Síndrome de Fatiga crónica
BLOG
EXPLICACIÓN DE LOS DESCUBRIMIENTOS POR LOS QUE SE HA OTORGADO EL PREMIO NOBEL DE MEDICINA 2019
El Premio Nobel de Medicina 2019 se ha otorgado conjuntamente a: William G. Kaelin Jr., Sir Peter J. Ratcliffe y Gregg L. Semenza

– William G. Kaelin, Jr., USA. 61 años. Profesor de Medicina del Instituto del Cáncer Dana-Farber de la Facultad de Medicina de Harvard e investigador del Instituto Médico Howard Hughes. Harvard Medical School y Médico en el Brigham and Women's Hospital.
– Sir Peter J. Ratcliffe, England, 65 años. Director de investigación clínica de la Universidad de Oxford en el Instituto Francis Crick, Londres y director del Instituto Target Discovery en Oxford
– Gregg L. Semenza, USA. 63 años. Profesor de pediatría, radioterapia y ciencias de radiación molecular, química biológica, medicina y oncología en la Facultad de medicina de la Universidad Johns Hopkins. Es el actual director del programa vascular del Institute for Cell Engineering
Por sus descubrimientos sobre cómo las células perciben y se adaptan a la disponibilidad de oxígeno.
William G. Kaelin Jr., Sir Peter J. Ratcliffe y Gregg L. Semenza descubrieron cómo las células pueden detectar y adaptarse a los cambios en la disponibilidad de oxígeno. Identificaron la maquinaria molecular que regula la actividad de los genes en respuesta a niveles variables de oxígeno. Y establecieron las bases para nuestra comprensión de cómo los niveles de oxígeno afectan el metabolismo celular y la función fisiológica. Sus descubrimientos también han allanado el camino para nuevas y prometedoras estrategias para combatir la anemia, el cáncer y muchas otras enfermedades.
Oxígeno en el centro del escenario y premios nobel anteriores.
El oxígeno, con la fórmula O2, constituye aproximadamente una quinta parte de la atmósfera de la Tierra. El oxígeno es esencial para la vida animal: es utilizado por las mitocondrias presentes en prácticamente todas las células animales para convertir los alimentos en energía útil.
- Otto Warburg, ganador del Premio Nobel de Medicina de 1931, reveló que esta conversión de alimentos en energía es un proceso enzimático.
Durante la evolución, se desarrollaron mecanismos para garantizar un suministro suficiente de oxígeno a los tejidos y las células. El cuerpo carotídeo, adyacente a los vasos sanguíneos grandes a ambos lados del cuello, contiene células especializadas que detectan los niveles de oxígeno en la sangre.
- Corneille Heymans, Premio Nobel de Medicina de 1938 descubrimiento mostrando cómo la detección de oxígeno en la sangre a través del cuerpo carotídeo controla nuestra frecuencia respiratoria al comunicarse directamente con el cerebro.
Factor inducible por hipoxia (HIF) entra en escena
Además de la adaptación rápida controlada por el cuerpo carotídeo a niveles bajos de oxígeno (hipoxia), existen otras adaptaciones fisiológicas fundamentales. Una respuesta fisiológica clave a la hipoxia es el aumento de los niveles de la hormona eritropoyetina (EPO), que conduce a una mayor producción de glóbulos rojos (eritropoyesis). La importancia del control hormonal de la eritropoyesis ya se conocía a principios del siglo XX, pero la forma en que este proceso fue controlado por el O2 siguió siendo un misterio.
- El Dr. Gregg Semenza estudió el gen EPO y cómo está regulado por niveles variables de oxígeno. Al usar ratones modificados con genes, se demostró que segmentos específicos de ADN ubicados al lado del gen EPO median la respuesta a la hipoxia.
- Sir Peter Ratcliffe también estudió la regulación dependiente de O2 del gen EPO, y ambos grupos de investigación encontraron que el mecanismo de detección de oxígeno estaba presente en prácticamente todos los tejidos, no solo en las células renales donde normalmente se produce EPO. Estos fueron hallazgos importantes que muestran que el mecanismo era general y funcional en muchos tipos de células diferentes.
El Dr. Gregg Semenza deseaba identificar los componentes celulares que median esta respuesta. En las células hepáticas cultivadas descubrió un complejo proteico que se une al segmento de ADN identificado de una manera dependiente del oxígeno. Llamó a este complejo el factor inducible por hipoxia (HIF). Se iniciaron grandes esfuerzos para purificar el complejo HIF, y en 1995, Semenza pudo publicar algunos de sus hallazgos clave, incluida la identificación de los genes que codifican HIF. Se descubrió que HIF consistía en dos proteínas de unión a ADN diferentes, llamadas factores de transcripción, ahora llamados HIF-1α y ARNT. Ahora los investigadores podrían comenzar a resolver el rompecabezas, permitiéndoles comprender qué componentes adicionales estaban involucrados y cómo funciona la maquinaria.
VHL: un socio inesperado
Cuando los niveles de oxígeno son altos, las células contienen muy poco HIF-1α. Sin embargo, cuando los niveles de oxígeno son bajos, la cantidad de HIF-1α aumenta para que pueda unirse y así regular el gen EPO y otros genes con segmentos de ADN que se unen a HIF. Varios grupos de investigación mostraron que HIF-1α, que normalmente se degrada rápidamente, está protegido de la degradación en la hipoxia.
- A niveles normales de oxígeno, una estructura celular llamada proteasoma, descubierta y merecedora del Premio Nobel de Química 2004, a Aaron Ciechanover, Avram Hershko e Irwin Rose, degrada el HIF-1α.
En tales condiciones, se agrega un péptido pequeño, ubiquitina, a la proteína HIF-1α. La ubiquitina funciona como una etiqueta para proteínas destinadas a la degradación en el proteasoma. ¿Cómo la ubiquitina se une al HIF-1α de manera dependiente del oxígeno? siguió siendo una cuestión central.
La respuesta vino de una dirección inesperada.
Casi al mismo tiempo que Semenza y Ratcliffe estaban explorando la regulación del gen EPO, el investigador del cáncer William Kaelin, Jr. estaba investigando un síndrome hereditario, la enfermedad de von Hippel-Lindau (enfermedad de VHL).
Esta enfermedad genética conduce a un riesgo dramáticamente mayor de ciertos tipos de cáncer en familias con mutaciones de VHL heredadas. Kaelin demostró que el gen VHL codifica una proteína que previene la aparición de cáncer y también mostró que las células cancerosas que carecen de un gen VHL funcional expresan niveles anormalmente altos de genes regulados por hipoxia; pero que cuando el gen VHL se reintrodujo en las células cancerosas, se restablecieron los niveles normales. Esta fue una pista importante que muestra que la VHL estuvo de alguna manera involucrada en el control de las respuestas a la hipoxia. Se obtuvieron pistas adicionales de varios grupos de investigación que muestran que VHL es parte de un complejo que etiqueta las proteínas con ubiquitina, marcándolas para la degradación en el proteasoma. Ratcliffe y su grupo de investigación hicieron un descubrimiento clave: demostrar que la VHL puede interactuar físicamente con HIF-1α y es necesario para su degradación a niveles normales de oxígeno. Esto demuestró concluyentemente la vinculación entre VHL y HIF-1α.
El oxígeno aumenta el equilibrio
Muchas piezas habían caído en su lugar, pero lo que aún faltaba era una comprensión de cómo los niveles de O2 regulan la interacción entre VHL y HIF-1α. La búsqueda se centró en una porción específica de la proteína HIF-1α que se sabe que es importante para la degradación dependiente de VHL, y tanto Kaelin como Ratcliffe sospecharon que la clave para la detección de O2 residía en algún lugar de este dominio proteico.
En 2001, en dos artículos publicados simultáneamente pero independientemente, mostraron que con niveles normales de oxígeno, se agregan grupos hidroxilo en dos posiciones específicas en HIF-1α. Esta modificación de la proteína, llamada prolil- hidroxilación, permite que VHL reconozca y se una a HIF-1α y, por lo tanto, explica cómo los niveles normales de oxígeno controlan la degradación rápida de HIF-1α con la ayuda de enzimas sensibles al oxígeno (llamadas prolil- hidroxilasas). Investigaciones posteriores de Ratcliffe y otros identificaron las prolil-hidroxilasas responsables. También se demostró que la función de activación de genes de HIF-1α estaba regulada por hidroxilación dependiente de oxígeno. Los premios Nobel ahora habían aclarado el mecanismo de detección de oxígeno y habían demostrado cómo funciona.
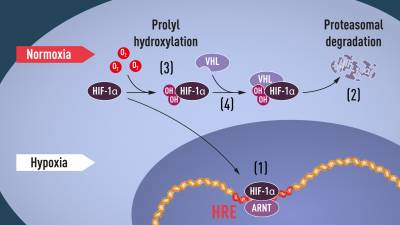
1. Cuando los niveles de oxígeno son bajos (hipoxia), HIF-1α está protegido de la degradación y se acumula en el núcleo, donde se asocia con ARNT (translocador nuclear del receptor de aril hidrocaruros ) y se une a secuencias de ADN específicas del elemento de respuesta a la hipoxia (HRE) en genes regulados por hipoxia.
2. A niveles normales de oxígeno, el proteasoma degrada rápidamente HIF-1α.
3. El oxígeno regula el proceso de degradación mediante la adición de grupos hidroxilo (OH) a HIF-1α .
4. La proteína VHL puede reconocer y formar un complejo con HIF-1α que conduce a su degradación de una manera dependiente del oxígeno .
El oxígeno da forma a la fisiología y la patología.
Gracias al trabajo innovador de estos premios Nobel, sabemos mucho más sobre cómo los diferentes niveles de oxígeno regulan los procesos fisiológicos fundamentales. La detección de oxígeno permite a las células adaptar su metabolismo a niveles bajos de oxígeno:
- por ejemplo, en nuestros músculos durante el ejercicio intenso.
Otros ejemplos de procesos adaptativos controlados por la detección de oxígeno incluyen
- la generación de nuevos vasos sanguíneos y la producción de glóbulos rojos.
Nuestro sistema inmunológico y muchas otras funciones fisiológicas también están afinadas por la maquinaria de detección de O2. Incluso se ha demostrado que la detección de oxígeno es esencial durante el desarrollo fetal para controlar la formación normal de vasos sanguíneos y el desarrollo de placenta.
La detección de oxígeno es fundamental para una gran cantidad de enfermedades.
- Por ejemplo, los pacientes con insuficiencia renal crónica a menudo sufren de anemia severa debido a la disminución de la expresión de EPO. EPO es producido por células en el riñón y es esencial para controlar la formación de glóbulos rojos.
Además, la maquinaria regulada por oxígeno tiene un papel importante en el cáncer.
- En los tumores, la maquinaria regulada por oxígeno se utiliza para estimular la formación de vasos sanguíneos y remodelar el metabolismo para la proliferación efectiva de células cancerosas.
Muchos procesos patológicos también se ven afectados. Se están realizando esfuerzos intensos para desarrollar nuevos medicamentos que puedan inhibir o activar la maquinaria regulada por oxígeno para el tratamiento de la anemia, el cáncer y otras enfermedades.
El mecanismo para la detección de oxígeno tiene una importancia fundamental en la fisiología, por ejemplo, para nuestro metabolismo, la respuesta inmune y la capacidad de adaptación al ejercicio.
CONCLUSIONES
- El oxígeno es esencial para la vida: es utilizado por las mitocondrias presentes en prácticamente todas las células del cuerpo humano, para convertir los alimentos en energía útil.
- La adaptación rápida a niveles bajos de oxígeno (hipoxia) es controlada por el cuerpo carotídeo, pero la respuesta clave a la hipoxia es el aumento de los niveles de la hormona eritropoyetina (EPO)
- Pero la sintesis de Epo está a su vez regulada por el factor el inducible por hipoxia (HIF) y por la proteina VHL ( von Hippel-Lindau), (Semenza, Ratcliffe y Kaelin Jr)
PUBLICACIONES CLAVES
- Semenza, G.L, Nejfelt, M.K., Chi, S.M. & Antonarakis, S.E. (1991). Hypoxia-inducible nuclear factors bind to an enhancer element located 3’ to the human erythropoietin gene. Proc Natl Acad Sci USA, 88, 5680-5684
- Wang, G.L., Jiang, B.-H., Rue, E.A. & Semenza, G.L. (1995). Hypoxia-inducible factor 1 is a basic-helix-loop-helix-PAS heterodimer regulated by cellular O2Proc Natl Acad Sci USA, 92, 5510-5514
- Maxwell, P.H., Wiesener, M.S., Chang, G.-W., Clifford, S.C., Vaux, E.C., Cockman, M.E., Wykoff, C.C., Pugh, C.W., Maher, E.R. & Ratcliffe, P.J. (1999). The tumour suppressor protein VHL targets hypoxia-inducible factors for oxygen-dependent proteolysis. Nature, 399, 271-275
- Mircea, I., Kondo, K., Yang, H., Kim, W., Valiando, J., Ohh, M., Salic, A., Asara, J.M., Lane, W.S. & Kaelin Jr., W.G. (2001) HIFa targeted for VHL-mediated destruction by proline hydroxylation: Implications for O2Science, 292, 464-468
- Jakkola, P., Mole, D.R., Tian, Y.-M., Wilson, M.I., Gielbert, J., Gaskell, S.J., von Kriegsheim, A., Heberstreit, H.F., Mukherji, M., Schofield, C.J., Maxwell, P.H., Pugh, C.W. & Ratcliffe, P.J. (2001). Targeting of HIF-α to the von Hippel-Lindau ubiquitylation complex by O2-regulated prolyl hydroxylation. Science, 292, 468-472
REFERENCIAS
https://www.nobelprize.org/prizes/medicine/2019/press-release/
TRADUCCIÓN Y COMENTARIOS: PROF. DR. FERNANDO GALAN




